
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂
质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。

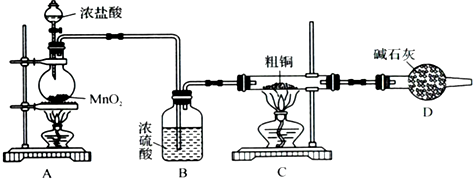
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。

① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要
(填“是”或“否”) 。
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号) 。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH) 2CO3 e.CuSO4
(3)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) +4Cl-(aq)  CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l)
蓝色 绿色
① 上述反应的化学平衡常数表达式是K= 。若增大氯离子浓度,K值(填“增大”、“减小”或“不变”) 。
② 取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号) 。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
(1)①分液漏斗 ②MnO2 +4H++2Cl- Mn2++ Cl2↑+2H2O
Mn2++ Cl2↑+2H2O
③否
(2)c d
(3)①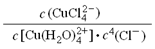 不变
不变
②abc
【解析】
试题分析:(1)①仪器A的名称是分液漏斗;②B装置是制取氯气的装置,发生的离子方程式为
MnO2 +4H++2Cl- Mn2++ Cl2↑+2H2O;③氯气中即使含有氯化氢也与反应无关,因为氯化氢与铜不反应,所以没必要增加,填“否“
Mn2++ Cl2↑+2H2O;③氯气中即使含有氯化氢也与反应无关,因为氯化氢与铜不反应,所以没必要增加,填“否“
(2)溶液1呈酸性,需加碱调节pH,加入ab可调节pH,但引入了新的杂质,错误;加入e无法调节pH,错误;加入cd,CuO 、Cu2(OH) 2CO3均可与盐酸反应产生氯化铜,既调节pH又不引入新的杂质,正确,答案选cd。
(3)①根据平衡常数的定义得K=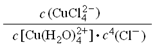
K只与温度有关,所以增大氯离子浓度,K值不变
②a、将Y稀释,溶液呈蓝色,说明平衡逆向移动,正确;b、加入CuCl2晶体,氯离子浓度增大,平衡正向移动,溶液呈绿色,正确;c、原理同b,正确;d、取Y进行电解,溶液颜色最终消失
,铜离子被还原,溶液颜色消失,与上述反应无关,错误,答案选abc。
考点:考查氯气的制法,离子方程式的书写,仪器名称,溶液中平衡的移动及除杂问题


科目:高中化学 来源: 题型:阅读理解

| ||
| ||

| 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH | |
| Cu2+ Fe2+ Fe3+ |
4.7 4.0 1.9 |
6.7 9.0 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)c(Cu
| ||
c[Cu
|
c(Cu
| ||
c[Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
| c(CuCl 42- ) |
| c[Cu(H2O) 42+ ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42+ ]?c4(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
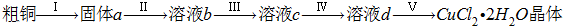
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com