
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量)。
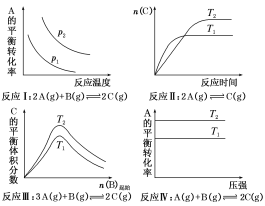
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1B.反应Ⅱ:ΔH<0,T1<T2
C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1D.反应Ⅳ:ΔH<0,T2>T1
科目:高中化学 来源: 题型:
【题目】氢是重要而洁净的能源。要利用氢气作为能源,必须解决好安全有效地储存氢气的问题。镧 (La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,有 关其说法正确的是

A.属于金属晶体
B.该合金的化学式为 La7Ni12
C.其熔点比组分金属高,硬度比组分金属大
D.设该结构单元的体积为 Vcm3,NA 为阿伏伽德罗常数,合金的摩尔质量为 M g/mol。则该合金的密度为ρ= ![]() g/ cm3
g/ cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
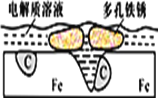
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图:
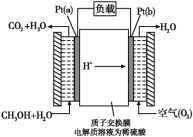
请回答下列问题:
(1)Pt(a)电极反应为________;如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有________mol。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式________。
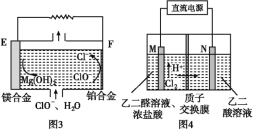
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛(OHC—CHO)与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为________。
②若2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe2+、Al3+、NH4+、Cl、CO32 和SO42。现每次取100.00mL进行实验:(已知:NH4++OH - ![]() NH3↑ +H2O)
NH3↑ +H2O)
① 第一份加入AgNO3溶液有沉淀产生;
② 第二份加入足量NaOH后加热,收集到气体0.896 L(标准状况下)
③ 第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。请回答:
(1)c(CO32) =_________mol/L;
(2)K+ 是否存在?__________;若存在,浓度范围是__________(若不存在,则不必回答第2问);
(3)根据以上实验,不能判断______(填离子符号)是否存在。若存在此离子,如何进行检验?_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K(25℃) |
|
|
|
①写出H2S的Ka1的表达式:________________。
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是_______。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是_______________。
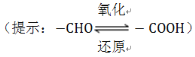
(2)室温下,用0.100 mol·L-1 盐酸溶液滴定20.00 mL 0.100 mol·L-1 的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①②填“>”“<”或“=”)
①a点所示的溶液中c(NH3·H2O)___________c(Cl-)。
②b点所示的溶液中c(Cl-)___________c(NH4+)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为__________。
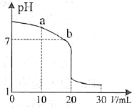
(3)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知PH3与NH3结构相似,回答下列问题:
①PH3的电子式________,结构式________。
②几何构型为________。
③中心原子采取________杂化。
④PH3分子中的化学键________(填“有”或“无”)极性,其分子为________(填“极性”或”非极性”)分子。
⑤PH3与NH3的热稳定性:________更强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某常见微粒X的结构模型可表示为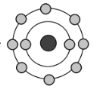 (
(![]() 代表电子),下列有关X的说法正确的是( )
代表电子),下列有关X的说法正确的是( )
A.微粒X的组成元素不可能是第三周期元素
B.X的组成元素一定是氖元素
C.若X的组成元素原子的核电荷数为8,则X是![]()
D.若X的核内质子数比电子数多,则X最多有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
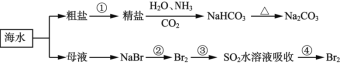
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com