
| A. | 溴苯 | B. | 乙醇 | C. | 四氯化碳 | D. | 苯 |
科目:高中化学 来源: 题型:选择题
| A. | Ksp(AgI)>Ksp(AgCl) | |
| B. | 加过量KI溶液充分反应后,溶液中Ag+和I-的浓度之积大于Ksp(AgI) | |
| C. | 加过量KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积大于Ksp(AgCl) | |
| D. | 以上结论都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成→取代→取代→取代 | B. | 取代→加成→取代→取代 | ||
| C. | 取代→取代→加成→取代 | D. | 取代→取代→取代→加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
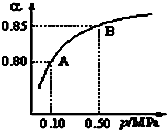
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室里用乙醇和浓硫酸来制取乙烯:
实验室里用乙醇和浓硫酸来制取乙烯:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花和蚕丝的主要成分都是纤维素 | |
| B. | 植物油属于油脂,它是一种高分子化合物 | |
| C. | 蔗糖在稀硫酸的催化下,最终全部水解为葡萄糖 | |
| D. | 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
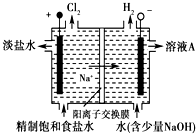 氯碱工业中电解饱和食盐水的原理示意图如图所示
氯碱工业中电解饱和食盐水的原理示意图如图所示查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称量时,将固体NaOH放在小烧杯中,再放在天平左盘上 | |
| B. | 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
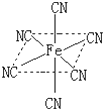 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com