
| A.NaCl、MgCl2、KF、Na2O | B.KF、Na2O、NaCl、MgCl2 |
| C.Na2O、NaCl、MgCl2、KF | D.MgCl2、NaCl、KCl、KF |
科目:高中化学 来源:不详 题型:实验题
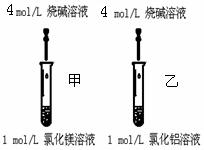

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 试回答:
试回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最外层上只有一个电子 | B.最外层电子数为次外层电子数的一半 |
| C.M层电子数为K层电子数的1/2 | D.K、L层电子数之和比M、N层电子数之和少1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.22 、26、 11 | B.13 、15 、35 | C.9、36 、16 | D.18 、12 、14 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 X
X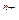 和
和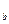 Y
Y 两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是
两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是| A.X与Y处于同一周期 | B.原子序数:a<b |
| C.a-b=m+n | D.离子半径:X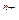 >Y >Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com