
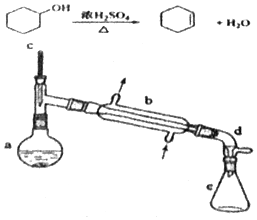
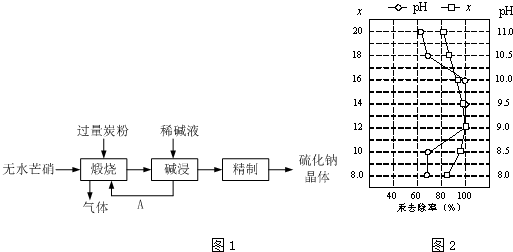
 分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:
分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
分析 在a中加入20g环己醇和2小片碎瓷片,碎瓷片能防暴沸,冷却搅动下慢慢加入1mL浓硫酸,相当于浓硫酸的稀释,不能将环己醇倒入浓硫酸中;b中通入冷却水后,开始缓慢加热a,在浓硫酸作催化剂条件下,环己醇发生消去反应生成环己烯,根据二者沸点知,要想得到较纯净的环己烯,应该控制馏出物的温度不超过90℃;反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,氯化钙作干燥剂,然后静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g,
(1)装置b的名称是冷凝管;
(2)碎瓷片有放暴沸作用;补加碎瓷片时需要待已加热的试液冷却后再加入;
(3)分液漏斗在使用前须清洗干净并检漏;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出;
(4)无水氯化钙能作干燥剂;
(5)在环己烯粗产物蒸馏过程中,根据各仪器的作用选取仪器;
解答 解:在a中加入20g环己醇和2小片碎瓷片,碎瓷片能防暴沸,冷却搅动下慢慢加入1mL浓硫酸,相当于浓硫酸的稀释,不能将环己醇倒入浓硫酸中;b中通入冷却水后,开始缓慢加热a,在浓硫酸作催化剂条件下,环己醇发生消去反应生成环己烯,根据二者沸点知,要想得到较纯净的环己烯,应该控制馏出物的温度不超过90℃;反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,氯化钙作干燥剂,然后静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g,
(1)装置b的名称是冷凝管,故答案为:冷凝管;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入,故选D,
故答案为:防止暴沸;B;
(3)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出,
故答案为:检漏;上口倒出;
(4)分离提纯过程中加入无水氯化钙的目的是利用无水氯化钙吸收产物中少量的水,
故答案为:干燥;
(5)观察题目提供的实验装置图知蒸馏过程中不可能用到分液漏斗,
故选:C;
点评 本题考查制备实验方案设计,为高频考点,明确实验原理及实验操作顺序是解本题关键,注意从实验安全性、评价性、操作规范性等方面分析解答,充分利用题给信息解答问题,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层 的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1 mol H2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ | |
| C. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJ | |
| D. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)吸收的热量为184.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
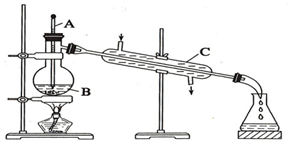 工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.回答下列问题
工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发废旧电池综合利用技术,防止重金属盐对土壤水资源造成污染 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 倡导低碳生活,使用太阳能、风能等代替化石燃料,可减少温室气体的排放 | |
| D. | 垃圾是放错地方的资源,应分类回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 3mol/L的KCl溶液 | B. | 30mL 1mol/L的NaCl溶液 | ||
| C. | 30mL 3mol/L的FeCl3溶液 | D. | 10mL3mol/L的AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com