
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑤ | C. | ②④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把金属铁放入稀硫酸中:Fe+2H+═Fe3++H2↑ | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 向氢氧化铜中滴加稀盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维--硅酸盐材料 | B. | 透明饮料瓶--合金材料 | ||
| C. | 纯棉织物--合成纤维材料 | D. | 橡胶轮胎--有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
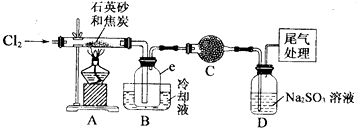
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 315 | |
| 熔点/℃ | -70.0 | ||
| 升华温度/℃ | 180 | 300 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中含有的H+数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com