
【题目】25℃时,将1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH 或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 该温度下,醋酸的电离平衡常数Ka=![]()
B. a点对应的混合溶液中c(CH3COOH)>c(Na+)>c(OH-)
C. 水的电离程度:c>b>a
D. 当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
【答案】A
【解析】1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合溶液的pH=4.3,溶液显酸性,加入醋酸后,溶液酸性增强,加入醋酸钠,溶液的酸性减弱。A.该温度下,1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合溶液的pH=4.3,醋酸的电离平衡常数Ka=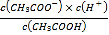 =
=![]() ≈
≈![]() =
=![]() ,故A错误;B. a点溶液的pH=3.1,是加入的醋酸后的结果,根据电荷守恒知,c(CH3COO-)>c(Na+),醋酸的电离程度较小,则c(CH3COOH)>c(Na+)>c(OH-),故B正确;C. a以醋酸的电离为主,抑制水的电离,酸性越强,水的电离程度越小,b点加入醋酸水的电离程度减小,c点加入醋酸钠,水的电离程度增大,故水的电离程度c>b>a,故C正确;D. 当混合溶液呈中性时,c(H+)=c(OH-),根据电荷守恒有c(Na+)=c(CH3COO-),则c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故D正确;故选A。
,故A错误;B. a点溶液的pH=3.1,是加入的醋酸后的结果,根据电荷守恒知,c(CH3COO-)>c(Na+),醋酸的电离程度较小,则c(CH3COOH)>c(Na+)>c(OH-),故B正确;C. a以醋酸的电离为主,抑制水的电离,酸性越强,水的电离程度越小,b点加入醋酸水的电离程度减小,c点加入醋酸钠,水的电离程度增大,故水的电离程度c>b>a,故C正确;D. 当混合溶液呈中性时,c(H+)=c(OH-),根据电荷守恒有c(Na+)=c(CH3COO-),则c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故D正确;故选A。


科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,11℃时液化成红棕色液体。
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
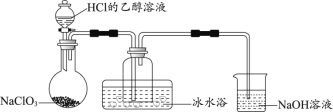
①冰水浴的作用是____________。
②NaOH溶液的主要作用为吸收反应产生的Cl2,其吸收液可用于制取漂白液,该吸收反应的氧化剂与还原剂之比为___________________。
③以NaClO3和HCl为原料制备ClO2的化学方程式为_________________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到________,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生Cl-,其含量一般控制在0.3-0.5 mg·L1,某研究小组用下列实验方案测定长期不放水的自来水管中Cl-的含量:量取10.00 mL的自来水于锥形瓶中,以K2CrO4为指示剂,用0.0001mol·L-1的AgNO3标准溶液滴定至终点。重复上述操作三次,测得数据如下表所示:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液的体积/mL | 10.24 | 10.02 | 9.98 | 10.00 |
①在滴定管中装入AgNO3标准溶液的前一步,应进行的操作_____________。
②测得自来水中Cl-的含量为______ mg·L1。
③若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气,反应为:C(S) + H2O(g)![]() CO(g) + H2(g) △H = + 131.3 kJ·mol-1一定温度下,在一个容积可变的容器中,发生上述反应,能确定该反应达到化学平衡状态的是_______________ (填标号)。
CO(g) + H2(g) △H = + 131.3 kJ·mol-1一定温度下,在一个容积可变的容器中,发生上述反应,能确定该反应达到化学平衡状态的是_______________ (填标号)。
A.容器中的压强不变
B.1mol H—H键断裂的同时断裂2mol H—O键
C.v正(H2O) = v逆(H2O)
D.c(CO) = c(H2)
(2)一定条件下,利用CO与H2。反应可制得甲醇:CO(g) +2H2(g) ![]() CH3OH (g)图1表示该反应进行过程中的能量变化,图2表示一定温度下,在体积为2L的密闭容器中加入4 molH2和一定量的CO后,CO和CH3OH的浓度随时间变化情况。
CH3OH (g)图1表示该反应进行过程中的能量变化,图2表示一定温度下,在体积为2L的密闭容器中加入4 molH2和一定量的CO后,CO和CH3OH的浓度随时间变化情况。
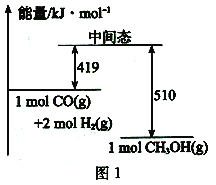
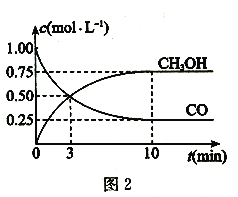
①根据图l,写出在该条件下CO制备甲醇气体的热化学方程式:___________。
②根据图2,计算该温度下反应CO(g) + 2H2(g) ![]() CH3OH (g)的平衡常数为____。
CH3OH (g)的平衡常数为____。
③以甲醇为燃料的新型燃料电池,正极通入O2,负极通入CH3OH,在KOH溶液中CH3OH与O2作用生成H2O和K2CO3 。 写出正极的电极反应式____________;放电时,OH-移向电池的_________(填“正”或“负")极。
(3)氯化铵溶液因NH4+离子水解使溶液呈______性,要使氯化铵溶液变为中性又不引入新杂质应选用_________(填“盐酸”或“氨水"或“氢氧化钠")。
(4)现有25℃时,pH=13的Ba(OH )2溶液。求:
① 该Ba(OH)2溶液中OH-的物质的量浓度为_____________________。
② 该Ba(OH)2溶液的物质的量浓度为_____________________。
(5)用惰性电极电解Cu(NO3)2溶液时,如果阴极上有1.92g铜析出,则阳极上产生气体的体积(标准状况下)约为____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法不正确的是( )
A. 若将四种溶液稀释100倍,稀释后溶液pH大小顺序:③>④>②>①
B. 等体积的②和③混合生成强酸弱碱盐,混合后溶液呈酸性
C. 等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④
D. 等体积的①和②分别与足量的锌粒反应生成的氢气在同温同压下体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物电池可进行多种污水净化和海水淡化的综合处理,该电池装置的示意图如图所示,其中污
水中的有机物用C6H10O5表示,海水用食盐水代替。下列说法正确的是

A. b膜为阴离子交换膜
B. 处理后的含NO3-污水的pH降低
C. 负极反应式为C6H10O5+7H2O+24e-==6CO2↑+24H+
D. 导线中流过lmol电子,理论上有1molCl-通过a膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图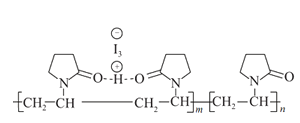 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
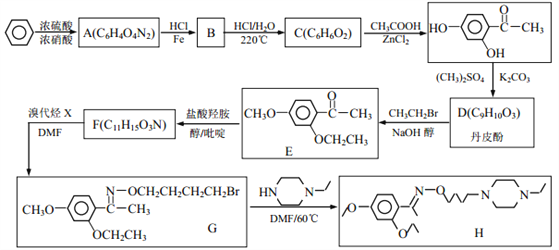
【题目】乙基丹皮酚肟胺基醇醚衍生物(H)具有很好的抗血小板聚集活性,是良好的心脑血管疾病的治疗药物。
已知:①![]()
②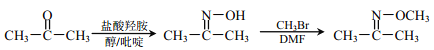
③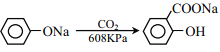
请回答:
(1)E中含有的官能团名称为_________;
(2)丹皮酚的结构简式为_________;
(3)下列说法不正确的是(___)
A.乙基丹皮酚肟胺基醇醚衍生物 H 的分子式为 C21H34O3N3
B.物质B 可能溶于水,且能与盐酸反应生成有机盐
C. D→E 和 G→H 的反应类型均为取代反应
D.物质 C 能使浓溴水褪色,而且 1mol C 消耗 2molBr2
(4)写出 F→G 的化学方程式_________。
(5)写出满足下列条件 F 的所有同分异构体的结构简式_________。
①能发生银镜反应;1molF 与 2molNaOH恰好反应。
②1H-NMR 谱显示分子中含有 5 种氢原子; IR 谱显示有-NH2,且与苯环直接相连。
(6)阿司匹林也具有抑止血小板凝聚的作用。结合题给信息,请以硝基苯和乙酸酐为原料设计合理的路线制备阿司匹林(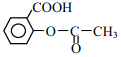 )。(用流程图表示,无机试剂任选)______。
)。(用流程图表示,无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A.根据图①可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)正反应是吸热反应
2AB3(g)正反应是吸热反应
B.图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,调节至pH在4左右。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com