
 常温下,实验测得1.0mol/L NH4HCO3溶液pH=8.0.平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )
常温下,实验测得1.0mol/L NH4HCO3溶液pH=8.0.平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )| A. | 常温下ka(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) | |
| B. | pH=13时,溶液中不存在HC03-的水解平衡 | |
| C. | pH由8~11时,$\frac{(C{O}_{3}^{2-})•c({H}^{+})}{c(HC{O}_{3}^{-})}$不变 | |
| D. | pH=3时,有c(NH4+)+c(NH3•H2O)═c(HCO3-)+c(CO32-)+c(H2CO3) |
分析 A、1.0mol/L NH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,根据盐类越弱越水解的原理分析;
B、据图象分析,pH=13时仍有HC03-;
C、$\frac{(C{O}_{3}^{2-})•c({H}^{+})}{c(HC{O}_{3}^{-})}$为HC03-的电离平衡常数表达式,其大小只受温度影响;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳.
解答 解:A、根据越弱越水解原理,1.0mol/L NH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,应有Kb(NH3•H2O)>ka(H2CO3)>Ka2(H2CO3),故A错误;
B、只要存在碳酸氢根离子就存在HC03-的水解平衡,故B错误;
C、温度不变,碳酸氢根离子的电离平衡常数不变,故C正确;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳,所以c(NH4+)+c(NH3•H2O)>c(HCO3-)+c(CO32-)+c(H2CO3),故D错误;
故选C.
点评 本题考查了盐类水解、根据图象分析溶液组成、电离平衡常数影响因素等,题目难度不大,易错题为D,注意pH=3时,NH4HCO3会与氢离子反应生成二氧化碳.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)>c(OH-)>c(H+) | D. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
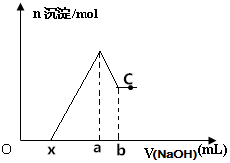 将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )
将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )| A. | C点对应的沉淀为Mg(OH)2 | |
| B. | Al的质量为27(b-a)×10-3 | |
| C. | 该合金与盐酸反应产生的H2为(a-x)×10-3mol | |
| D. | 由图可以确定x的取值范围为:0≤x<(4a-3b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①或② | B. | ①或④ | C. | ②或③ | D. | ②或④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是由一个1s轨道和一个2p轨道线性组合而成 | |
| B. | 等性sp杂化轨道中所含s、p的成分一样 | |
| C. | 等性sp杂化轨道有两个,一个能量升高,另一个能量降低,但总能量保持不变 | |
| D. | sp杂化轨道可与其他原子轨道形成σ键和π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与硝酸反应 | B. | 明矾溶液与烧碱溶液反应 | ||
| C. | 碳酸钠溶液和盐酸反应 | D. | 硫在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④⑥ | C. | ①④⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,向烧杯中滴加几滴浓盐酸,CaCO3固体还有剩余(忽略体积、温度的变化),下列数值变小的是( )
如图,向烧杯中滴加几滴浓盐酸,CaCO3固体还有剩余(忽略体积、温度的变化),下列数值变小的是( )| A. | c(Ca2+) | B. | c(CO32-) | C. | c(H+) | D. | c(碳酸钙的溶解度) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com