
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
分析 (1)H2C2O4与酸性KMnO4溶液发生氧化还原反应,H2C2O4被氧化成CO2,KMnO4被还原成Mn2+,根据电子得失守恒、质量守恒和电荷守恒来配平;
(2)KMnO4具有强氧化性,会腐蚀橡胶管;滴定终点时溶液颜色无色变化为紫色且在30s内颜色不再恢复为原来颜色,证明反应达到终点;
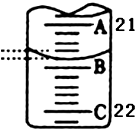
(3)A与C刻度间相差1ml,说明每两个小格之间是0.1mL,A处的刻度21,据此确定B的刻度,注意滴定管的上面数值小,下面数值大;
(4)根据所用过程判断不当操作对相关物理量的影响;
(5)根据化学方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O计算H2C2O4的浓度.
解答 解:(1)H2C2O4与酸性KMnO4溶液发生氧化还原反应,H2C2O4被氧化成CO2,KMnO4被还原成Mn2+,反应的离子方程式为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O;
故答案为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O;
(2)因为KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装;KMnO4溶液呈紫色,草酸反应完毕,当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
故答案为:酸式;当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色;
(3)A与C刻度间相差1ml,说明每两个小格之间是0.10mL,A处的刻度为21,A和B之间是四个小格,所以相差0.40mL,则B是21.40mL;
故答案为:21.40;
(4)A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积,液面偏高,读数偏小,导致KMnO4体积偏小,故A错误;
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡,导致KMnO4体积偏大,故B正确;
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗,KMnO4浓度偏小,导致KMnO4体积偏大,故C正确;
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,润洗锥形瓶导致草酸的物质的量偏大,导致KMnO4体积偏大,故D正确;
E、滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,导致KMnO4体积偏小,故E错误;
故选:BCD;
(5)三次滴定消耗KMnO4溶液体积分别为:26.32mLmL、25.35mL、25.30mL,第一次误差较大,舍去,mLmLmL消耗KMnO4溶液平均体积为$\frac{25.35mL+25.30mL}{2}$,消耗KMnO4物质的量为n(KMnO4)=cmol/L×$\frac{(25.35+25.30)×1{0}^{-3}L}{2}$,由2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O可知,n(H2C2O4)=$\frac{5}{2}$n(KMnO4)=$\frac{5}{2}$×cmol/L×$\frac{(25.35+25.30)×1{0}^{-3}L}{2}$,则草酸的浓度为$\frac{\frac{5}{2}×cmol/L×\frac{(25.35+25.30)×1{0}^{-3}L}{2}}{V×1{0}^{-3}L}$;
故答案为:$\frac{\frac{5}{2}×c×\frac{(25.35+25.30)}{2}×10{\;}^{-3}}{V×1{0}^{-3}}$.
点评 本题以物质含量为背景考查氧化还原滴定与计算,难度中等,注意实验原理的掌握,滴定管结构与使用等.


科目:高中化学 来源: 题型:选择题
| A. | 灼烧RbH时,火焰有特殊颜色 | |
| B. | RbH中H+半径比Li+半径小 | |
| C. | 跟液氨反应时,有RbNH2生成 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
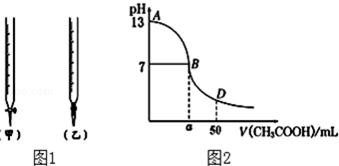
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
| 待测氢氧化钠 | 0.100mol/L醋酸的体积 | ||
| 滴定次数 | 溶液的体积(mL) | 滴定前的刻度(mL) | 滴定后的刻度(mL) |
| 第一次 | 25.00 | 1.68 | 26.89 |
| 第二次 | 25.00 | 0.00 | 27.91 |
| 第三次 | 25.00 | 0.12 | 25.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥氯气 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铝熔点很高,可用于制耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 2.8gN2和CO的混合气体中所含质子数为1.4NA | |
| C. | 235g${\;}_{92}^{235}$U发生裂变反应${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为9NA | |
| D. | 50mL12mol/L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O在高温下难分解,H2S在300℃即分解,说明氧的非金属性比硫强 | |
| B. | I-的还原性比Br-强,由此可推断溴的非金属性比碘强 | |
| C. | H2CO3的酸性比HClO的酸性强,说明碳的非金属性比氯强 | |
| D. | 已知反应:2NH3+3Cl2═N2+6HCl,由此可推断非金属性氯强于氮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com