
【化学—化学与技术】
工业合成上氨及氨氧化法制硝酸的流程图如下,回答下列问题:
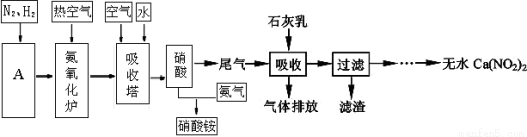
(1)工业合成氨的原料是N2和H2。设备A的名称是 ;其中N2可从空气中分离出来,方法是先将空气 ,然后 即可得到;H2可以水和天然气为原料在催化剂作用下高温制取,其化学方程式为_________ 。
(2)在原料气制备过程中必须进行脱硫,目的是____________________。
(3)利用石灰乳来除去硝酸工业的尾气(含NO、NO2),既能净化尾气,又能获得应用广泛的Ca(NO2)2,已知NO和NO2按1:1通入碱液中生成亚硝酸盐。
①上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是 ;滤渣可循环使用,滤渣的主要成分是 (填化学式)。
②该工艺需控制NO 和NO2 物质的量之比接近1:1。若n(NO):n(NO2)>1:1,则会导致 ;若n(NO):n(NO2)<1:1,则会导致 。
(4) 某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是95%,NO制HNO3的产率是90%,则制HNO3所用的NH3的质量占总耗NH3质量的 %(保留三位有效数值)。
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) ,下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极得电子反应产物是Mn2O3(s)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第六次适应性考试理综化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是
A.屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献
B.燃放烟花炮竹会加剧“雾霾” 的形成,当“雾霾”中粉尘颗粒直径小于2.5 μm时,可能发生丁达尔效应
C.陶瓷、水泥、玻璃、大理石属于硅酸盐产品
D.光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第二次模拟理综化学试卷(解析版) 题型:实验题
NaCN为剧毒无机物。某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
实验Ⅰ.硫代硫酸钠晶体(Na2S2O3·5H2O)的制备:
已知Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水。现以Na2CO3和Na2S物质的量之比为2∶1的混合溶液及SO2气体为原料,采用如图装置制备Na2S2O3·5H2O。
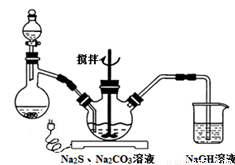
(1)将Na2S和Na2CO3按反应要求的比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在蒸馏烧瓶中加入Na2SO3固体,在分液漏斗中注入____________(填以下选择项的字母),并按下图安装好装置,进行反应。
A.稀盐酸 B.浓盐酸 C.70%的硫酸 D.稀硝酸
(2)pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色混浊。反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热。如果通入SO2过量,发生的化学反应方程式为___________;
(3)从上述生成物混合液中获得较高产率Na2S2O3·5H2O的歩骤为
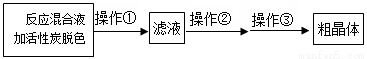
为减少产品的损失,操作①为趁热过滤,其目的是______________________________;操作②是___________________________________;操作③是_____、_____、抽滤、洗涤、干燥。
Ⅱ.产品纯度的检测:
(4)已知:Na2S2O3·5H2O的摩尔质量为248 g/mol;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品a g,加水溶解后,滴入几滴淀粉溶液,用0.010 mol/L碘水滴定到终点时,消耗碘水溶液v mL,则该样品纯度是______________________;
(5)滴定过程中可能造成实验结果偏低的是___________________;
A.锥形瓶未用Na2S2O3溶液润洗 B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数
C.滴定终点时仰视读数 D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
Ⅲ.有毒废水的处理:
(6)兴趣小组的同学在采取系列防护措施及老师的指导下进行以下实验:向装有2 mL 0.1 mol/L 的NaCN溶液的试管中滴加2 mL 0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10 mL 0.1 mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式____________________。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第二次模拟理综化学试卷(解析版) 题型:选择题
科学家开发出一种新型锂—氧电池,能量密度极高,效率达90%以上。电池中添加碘化锂(LiI)和微量水,工作原理如图,总反应为:O2+4LiI+2H2O 2I2+4LiOH。对于该电池的说法不正确的是
2I2+4LiOH。对于该电池的说法不正确的是
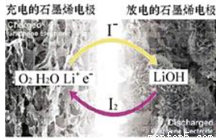
A.放电时负极上I-被氧化
B.充电时Li+从阳极区移向阴极区
C.充电时阴极反应为LiOH+e-= Li+OH-
D.放电时正极反应为O2+2H2O+4Li++4e-= 4LiOH
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷(解析版) 题型:选择题
用下列实验装置进行相应实验,装置正确且能达到实验目的的是
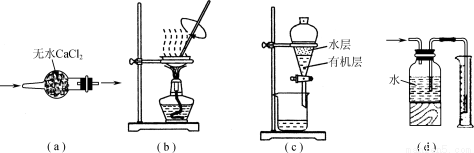
A.用图a所示装置干燥SO2气体
B.用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体
C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出
D.用图d所示装置测量氯气的体积
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:填空题
阅读下表中短周期主族元素的相关信息并填空。
元素代号 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是其内层电子数的三倍 |
C | 是地壳中含量最高的金属元素 |
D | A、B、D组成的化合物X是84消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
(1)E元素周期表中的位置 ;C的原子结构示意图 。
(2)X的化学式为 。
(3)A、B、D三种元素形成的简单离子半径由大到小的顺序为 (用离子符号表示)。
(4)A、B形成的一种原子个数比为1:1化合物的化学式为 。
(5)A在真空高压下能与由元素D、E组成化合物ED4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称。写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下列分子中所有原子都满足最外层为8电子结构的是
A.SiCl4 C.BF3 B.H2O D.PCl5
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第五次适应性考试理综化学试卷(解析版) 题型:选择题
向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是
A.氯气:K+、Na+、SiO32-、NO3- B.二氧化硫:Na+、NH4+、SO32-、C1-
C.乙烯:H+、K+、MnO4-、SO42- D.氨气:K+、Na+、AlO2-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com