
【题目】按要求完成下列各题:
(1)微粒铵根14N2H4+中的中子数是___________________ ,核外电子数是_____。
(2)写出 N2的电子式_________________,画出HClO分子的结构式_________________
CO2的电子式________________;Na2O2的电子式为___________________
(3)如图是元素周期表的一个方格  ,其中19.00的意义是______________
,其中19.00的意义是______________
(4) 25℃,101 kPa,1g C2H2气体充分燃烧生成气体CO2和液态H2O,放出125kJ的热量,写出C2H2燃烧热的热化学方程式_________________
【答案】11 10 ![]() H-O-Cl
H-O-Cl ![]()
![]() F元素的相对原子量 C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=-3250kJ·mol-1
F元素的相对原子量 C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=-3250kJ·mol-1
【解析】
(1)依据质量数=质子数+中子数,则14N2H4+中中子数为[14-7+(2-1)×4]=11;该离子为阳离子,其核外电子数=质子数-所带电荷数=(7+4-1)=10;
(2)N2中N和N之间以叁键形式结合,N2的电子式为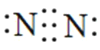 ;HClO的结构式为H-O-Cl;CO2中C和O之间以双键形式结合,即CO2的电子式为
;HClO的结构式为H-O-Cl;CO2中C和O之间以双键形式结合,即CO2的电子式为![]() ;Na2O2是离子化合物,含有离子键和非极性键,其电子式为
;Na2O2是离子化合物,含有离子键和非极性键,其电子式为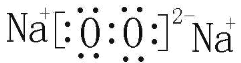 ;
;
(3)19.00表示F元素的相对原子量;
(4)根据燃烧热的定义,1molC2H2燃烧放出的热量为125kJ×26=3250kJ,表示C2H2燃烧热的热化学方程式为C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=-3250kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】氢化钠(NaH)是一种白色的离子化合物,其中钠显+1 价,NaH 与水反应放出氢气。下列叙述正确的是( )
A. NaH 在水中显酸性 B. 钠与其他碱金属都必须保存在煤油中
C. NaH 中氢离子半径比锂离子半径大 D. NaH 中氢离子被还原为氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图为几种晶体或晶胞的构型示意图。
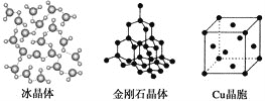
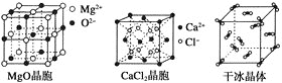
请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是___________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
A. 只有④ B. ②③ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把![]() 气体X和
气体X和![]() 气体Y混合于2L容器中,发生反应:
气体Y混合于2L容器中,发生反应:![]()
![]()
![]() ,5分钟末已生成
,5分钟末已生成![]() ,若测知以Z浓度变化来表示的平均速率为
,若测知以Z浓度变化来表示的平均速率为![]() ,则:上述反应在5分钟末时,已用去的Y占原有量的物质的量分数是( )
,则:上述反应在5分钟末时,已用去的Y占原有量的物质的量分数是( )
A. 20% B. 25% C. 33% D. 50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑该反应中还原剂是________________。(填化学式)
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:_____________。
②每生成2mol FeO42-转移________mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和1 mol FeBr2的溶液中通入2.5 mol Cl2,此时依次被氧化的离子是__________,被氧化的离子对应的物质的量之比是________________。
(2)若向含a mol FeI2和b mol FeBr2的混合溶液中通入c mol Cl2,当该混合溶液与通入的Cl2恰好完全反应时,a、b、c的关系为______________________(用含a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃的命名是否正确?若有错误加以改正,把正确的名称填在横线上:
(1) 2-乙基丁烷 _____________________________________;
2-乙基丁烷 _____________________________________;
(2)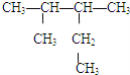 3,4-二甲基戊烷 ________________________________;
3,4-二甲基戊烷 ________________________________;
(3)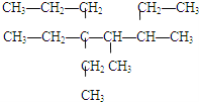 5-甲基-4,6三乙基庚烷 ____________________。
5-甲基-4,6三乙基庚烷 ____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com