
| A. | 反应①中,氧化剂与还原剂的物质的量之比为2:5 | |
| B. | 反应②中,Cu3P既是氧化产物又是还原产物 | |
| C. | 反应②中,当有5mol CuSO4发生反应时,共转移电子10mol | |
| D. | 反应①中CuSO4做氧化剂,反应②中CuSO4作还原剂 |
分析 2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4该反应中P元素化合价由0价变为5价,Cu元素化合价由+2价变为0价;11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4该反应中P元素化合价由0价变为-3价、+5价,Cu元素化合价由+2价变为+1价,如果有11molP参加氧化还原反应,则有$\frac{6}{11}$的P被氧化,其余的P被还原,据此分析解答.
解答 解:2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4该反应中P元素化合价由0价变为5价,Cu元素化合价由+2价变为0价;
11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4该反应中P元素化合价由0价变为-3价、+5价,Cu元素化合价由+2价变为+1价,如果有11molP参加氧化还原反应,则有$\frac{6}{11}$的P被氧化,其余的P被还原,
A、反应①中,氧化剂与还原剂的物质的量之比为5:2,故A错误;
B、反应②中,Cu3PP元素化合价由0价变为-3价,Cu元素化合价由+2价变为+1价,所以仅是还原产物,故B错误;
C.在反应②中,15molCuSO4转移30mol电子,则当有5mol CuSO4发生反应时,共转移10mol电子,故C正确;
D、反应①中CuSO4做氧化剂,反应②中CuSO4作氧化剂,故D错误;
故选C.
点评 本题考查氧化还原反应,明确元素化合价变化是解本题关键,注意该反应中P元素化合价变化,为易错点,侧重于考查学生对基础知识的应用能力.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
| 物质的量/mol 时间 | n(N2H4) | N(NO2) | N(N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 硫酸/mol•L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 14 | Cu 片表面无明显现象 | |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CN-可以和稀硫酸反应生成HCN | B. | CN-可被Cl2氧化成(CN)28 | ||
| C. | 在水溶液中(CN)2可被F-还原 | D. | HCN的电子式为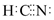 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 诜项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入浓硝酸 | 比较Fe和Cu的金属活动性 |
| D | 将铁钉放入试管中,下端浸入食盐水中 | 验证铁的吸氧腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.
A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.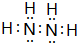 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Ba(OH)2溶液与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:Y<X | |
| B. | 最简单气态氢化物的稳定性:HmY>HnX | |
| C. | 最高价含氧酸的酸性:元素X对应酸的酸性强于Y | |
| D. | X和Y形成的化合物中,X显负价,Y显正价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com