
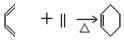
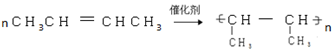 ②B→C
②B→C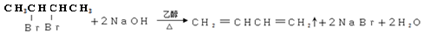
 .
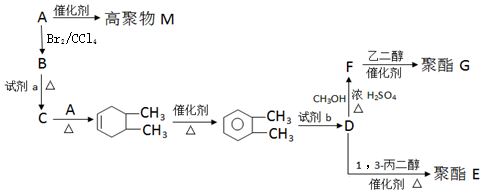
. 以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
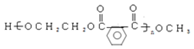
以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) 分析 根据题中各物质的转化关系,由A(C4H8)为直链烃,核磁共振氢谱有两组峰,则A为CH3CH2=CH2CH3,A发生加聚反应生成M为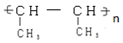 ,A与溴发生加成反应生成B为CH3CHBr=CHBrCH3,B在氢氧化钠的醇溶液中发生消去反应得C为CH2=CHCH=CH2,C与A发生信息中的加成反应生成
,A与溴发生加成反应生成B为CH3CHBr=CHBrCH3,B在氢氧化钠的醇溶液中发生消去反应得C为CH2=CHCH=CH2,C与A发生信息中的加成反应生成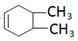 ,
,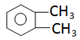 与高锰酸钾反应生成D为邻二苯甲酸,邻二苯甲酸与1,3-丙二醇发生缩聚反应生成E为
与高锰酸钾反应生成D为邻二苯甲酸,邻二苯甲酸与1,3-丙二醇发生缩聚反应生成E为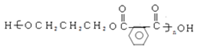 ,邻二苯甲酸与甲醇发生酯化反应生成F为
,邻二苯甲酸与甲醇发生酯化反应生成F为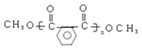 ,F与乙二醇发生信息Ⅱ中的反应生成G为
,F与乙二醇发生信息Ⅱ中的反应生成G为 ,以CH3CHO为初始原料,合成化合物CH2=CHCH=CH2,可以用乙醛与乙炔发生加成,再与氢气加成得CH2=CHCHOHCH3,将CH2=CHCHOHCH3再脱去一分子水可得CH2=CHCH=CH2,据此答题.
,以CH3CHO为初始原料,合成化合物CH2=CHCH=CH2,可以用乙醛与乙炔发生加成,再与氢气加成得CH2=CHCHOHCH3,将CH2=CHCHOHCH3再脱去一分子水可得CH2=CHCH=CH2,据此答题.
解答 解:(1)根据上面的分析可知,A的结构简式为 CH3CH2=CH2CH3,
故答案为:CH3CH2=CH2CH3;
(2)D为邻二苯甲酸,D所含官能团的名称为 羧基,
故答案为:羧基;
(3)根据上面的分析可知,试剂b为酸性高锰酸钾溶液,
故答案为:酸性高锰酸钾溶液;
(4)根据上面的分析可知,A→B的反应类型是加成反应,
故答案为:加成反应;
(5)①A→M的化学方程式为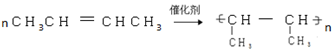 ,②B→C 化学方程式为
,②B→C 化学方程式为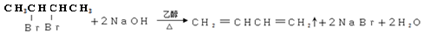 ,
,
故答案为: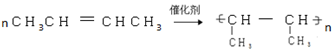 ;
;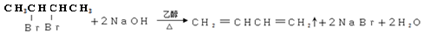 ;
;
(6)根据上面的分析可知,G为 ,
,
故答案为: ;
;
(7)以CH3CHO为初始原料,合成化合物CH2=CHCH=CH2,可以用乙醛与乙炔发生加成,再与氢气加成得CH2=CHCHOHCH3,将CH2=CHCHOHCH3再脱去一分子水可得CH2=CHCH=CH2,其合成路线 为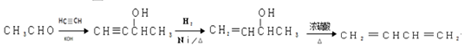 ,
,
故答案为: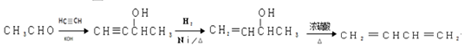 .
.
点评 本题考查有机物的推断,侧重于有机物官能团的性质以及学生分析能力的考查,解答本题的突破口为A,答题时注意把握题给信息,体会做题思路,可采用顺推的方法推断,题目难度中等.


科目:高中化学 来源: 题型:实验题
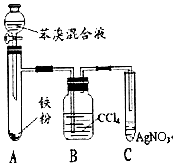 已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置.
已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管中剩余气体约占试管体积的$\frac{1}{2}$ | B. | 试管中剩余气体约占试管体积的$\frac{2}{3}$ | ||
| C. | 剩余气体呈红棕色 | D. | 剩余气体呈无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法计算 | B. | 1mol•L-1 | C. | 0.5mol•L-1 | D. | 1.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | X的最高价氧化物对应的水化物中只含有共价键 | |
| C. | X、Z形成的化合物一定为离子化合物 | |
| D. | 工业上常用Y的氯化物为原料制取单质Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上通常用电解钠、铁、铜对应的氯化物来制备这三种金属的单质 | |
| B. | 陶瓷、玻璃、水泥属于传统无机硅酸盐材料 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了“丹砂”,该过程无氧化还原反应发生 | |
| D. | “青篙一握,以水二升渍,绞取汁”屠呦呦对青蒿素的提取属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
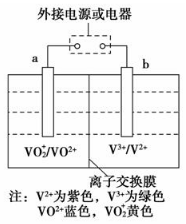 某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )
某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )| A. | 放电时,H+从左槽迁移进右槽 | |
| B. | 放电过程中,左槽溶液颜色由黄色变为蓝色 | |
| C. | 充电时,b极接直流电源正极,a极接直流电源负极 | |
| D. | 充电过程中,a极的电极反应式为:VO2++2H++e-═VO2++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com