
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
a.Ba(NO3)2 b.BaCl2 c.Ba(OH)2 d.溶有NH3的BaCl2溶液
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为 。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
 (3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
科目:高中化学 来源: 题型:
反应4A(s)+3B(g) 2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示正确的 是( )
A.在2 min内的反应速率,用C表示是0.3 mol·L-1·min-1
B.用A表示的反应速率是0.4 mol·L-1·min-1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.分别用B、C、D表示反应速率,其比值是3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O、②Na2FeO4+2KOH=K2FeO4+2NaOH。下列说法不正确的是
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中氧化产物与还原产物物质的量之比为2:9
C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒
D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氰化二铁和氰化亚铜。三氧化二铁和氧化亚铜都是红色粉末.常用作颜料。某学校化学兴趣小组通过实验米探究一红色粉末是Fe2O3、Cu2O或两者的混合物。探究过程如下:
【查阅资料】Cu2是一种碱性氧化物.溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】
假设1:红色粉末是Fe2O3。
假设2:红色粉末是Cu2O。
假设3:红色粉末是Fe2O3和Cu2O的混合物。
【设计探究实验】
取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是 。
(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含二氰化二铁。你认为这种说法合
理吗? 。简述你的理由(不需写出反应的化学方程式): 。
(3)若同体粉末完伞溶解尢同体存在.滴加KSCN试剂时溶液不变红色.则证明原同体粉末是 ,写出发生的氧化还原反应的离子方程式: 。
【探究延伸】
(4)绎实验分析.确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。纤杏阅资料得知.在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
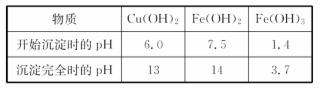
实验小组设汁如下实验方案:
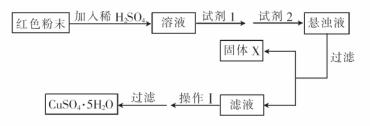
①试剂1为 .试剂2为 . (填字母)
A.氯水 B.H2O2 C.NaOH
②同体X的化学式为 。
③操作II为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法一定正确的是
A.反应A(s)  2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态
2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态
B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀
C.将33.6LNO2溶于D2O中得到1L溶液,该溶液的物质的量浓度为1.0mol·L-1
D.在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
下列能说明氯元素原子得电子能力比硫强的是( )
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强③HCl的稳定性比H2S强 ④HCl的还原性比H2S强⑤HClO的酸性比H2SO4强 ⑥Cl2能与H2S反应生成S ⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑧还原性:Cl- <S2-
A.③④⑤⑧ B.③⑥⑦ C.③⑥⑦⑧ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)绿色食品是指( )
A.绿颜色的营养食品 B.有叶绿素的营养食品
C.附加值高的营养食品 D.安全、无公害的营养食品
(2)下列垃圾中,不适合用卫生填埋、焚烧、堆肥等处理方法处理的是( )
A.腐败食品 B.电池 C.卫生纸 D.纯棉纺织品
(3)葡萄糖能发生银镜反应说明其结构中含有 基。
(4)维生素C可以与酸性高锰酸钾溶液反应,高锰酸钾中的锰元素生成正二价锰离子,那么维生素C发生了 (填“氧化”或“还原” )反应
(5)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和 (写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(6)氨基酸是组成蛋白质的基本结构单元,人体中共有二十多种氨基酸,其中人体自身
___ (填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com