

| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
分析 装置A:乙醇在浓硫酸、加热条件下发生消去反应生成乙烯,浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,装置B:B为安全瓶,可以防止倒吸,装置D生成1,2-二溴乙烷,反应后容器内气压减小,1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,根据B中内外液面高低变化,可以判断是否发生堵塞,装置C:二氧化碳、二氧化硫能和氢氧化钠溶液反应,二氧化硫能与溴反应,盛放氢氧化钠溶液除去乙烯中的二氧化碳、二氧化硫,装置D:乙烯与溴反应生成1,2-二溴乙烷;溴易挥发,为防止污染空气,D装置之后需要连接盛放氢氧化钠溶液吸收尾气装置.
(1)三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下加热到170℃产生乙烯;装置D生成1,2-二溴乙烷;
(2)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚;
(3)如果D中导气管发生堵塞事故,装置B中长导管液面会上升;
(4)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳;生成的酸性气体为SO2、CO2可以和氢氧化钠反应;
(5)液溴为红棕色,产物1,2-二溴乙烷为无色,根据颜色变化判断反应是否结束;
(6)1,2-二溴乙烷和水不互溶,密度比水大;
(7)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离.
解答 解:(1)制备1,2二溴乙烷的反应原理方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,CH2═CH2+Br2→BrCH2CH2Br
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O; CH2═CH2+Br2→BrCH2CH2Br;
(2)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,可能迅速地把反应温度提高到170℃左右,其最主要目的是:减少副产物乙醚生成;
故答案为:d;
(3)如果D中导气管发生堵塞事故,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,所以装置B中长玻璃管E的作用为判断装置是否堵塞,
故答案为:判断装置是否堵塞;
(4)浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,二氧化碳在水中溶解度小,高锰酸钾不能吸收二氧化碳,浓硫酸既不能吸收二氧化碳,也不能吸收二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应:SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,
故答案为:c;
(5)液溴为红棕色,产物1,2-二溴乙烷为无色,当反应结束时液溴全部转化为1,2-二溴乙烷,D中液体由红棕色变为无色
故答案为:D中溴水的颜色完全褪去;
(6)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,
故答案为:下;
(7)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏.
点评 本题考查有机物合成实验,主要考查了乙醇制备1,2-二溴乙烷,涉及制备原理、物质的分离提纯、实验条件控制、对操作分析评价等,是对基础知识的综合考查,需要学生具备扎实的基础,难度中等.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
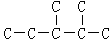 ,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH
,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是由极性键构成的非极性分子 | |
| B. | 若NA表示阿伏伽德罗常数,常温常压下60g SiO2中含有的共价键数目为2NA | |
| C. | 碳和硅同主族,因此CO2和SiO2化学性质相似,物理性质也相似 | |
| D. | SiO2晶体结构中的最小环为6个Si和6个O组成的12元环 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.1mol/L的AlCl3溶液 | B. | 20mL0.2mol/L的CaCl2溶液 | ||
| C. | 30mL0.2mol/L的KCl溶液 | D. | 10mL0.25mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
在0.lmol/L的CH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应方向移动
C.滴加少量0.l mol / L HCl溶液,溶液中c?H+?减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com