
| A. | 氢氧化钠与盐酸;氢氧化铜与盐酸 | B. | BaCl2与Na2SO4;Ba(OH)2与H2SO4 | ||
| C. | Na2CO3与硝酸;CaCO3与硝酸 | D. | 石灰石与硝酸反应;石灰石与盐酸 |
分析 A.氢氧化钠易溶于水,氢氧化铜是难溶于水,在离子方程式中氢氧化铜需要保留化学式;
B.氯化钡和硫酸钠反应生成硫酸钡和氯化钠,氢氧化钡和硫酸反应生成硫酸钡沉淀和水;
C.碳酸钠和硝酸反应生成硝酸钠、二氧化碳和水,而碳酸钙是难溶物,离子方程式中不能拆开;
D.石灰石、大理石的主要成分为碳酸钙,碳酸钙是难溶物,与硝酸、盐酸反应生成可溶性的硝酸钙、氯化钙、二氧化碳和水.
解答 解:A.氢氧化钠易溶于水,氢氧化钠与盐酸反应的离子方程式为:H++OH-=H2O,氢氧化铜是难溶于水,氢氧化铜与盐酸反应的碱反应的离子方程式为:Cu(OH)2+2H+=Cu2++2H2O,不能用同一离子方程式表示,故A错误;
B.氯化钡和硫酸钠反应生成硫酸钡和氯化钠,反应离子方程式为:Ba2++SO42-=BaSO4↓,氢氧化钡和硫酸反应生成硫酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,不能用同一离子方程式表示,故B错误;
C.碳酸钠和硝酸反应生成硝酸钠、二氧化碳和水,反应的离子方程式为:CO32-+2H+=CO2↑+H2O,碳酸钙是难溶物和硝酸反应的离子方程式为:CaCO3+2H+=CO2↑+H2O+Ca2+,不能用同一离子方程式表示,故C错误;
D.石灰石、大理石都是碳酸钙,是难溶物,硝酸、盐酸均为一元强酸,反应的离子方程式均为CaCO3+2H+=CO2↑+H2O+Ca2+,可以用同一离子方程式表示,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,如:难溶物、弱电解质等需要保留化学式,试题有利于培养学生灵活应用所学知识的能力.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 10g H2和10g N2 | B. | 1mol H2O和1g H2O | ||
| C. | 3.2g O2和2.24L的空气 | D. | 22gCO2和3.01×1023个O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4、HClO、BaCO3是电解质 | |
| B. | 生石灰与水混合发生化学、物理变化 | |
| C. | 丁达尔效应可以区分溶液与胶体 | |
| D. | 光导纤维中所用材料为晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
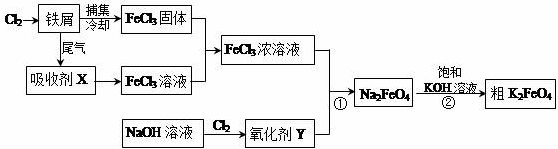
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若Ⅰ达平衡时,A、B、C各增加1mol,则A的转化率将一定增大 | |
| B. | 若向Ⅰ平衡体系中再加入1molA和3molB,C的体积分数若大于x,可断定n>3 | |
| C. | 若Ⅱ体系起始物质的量当满足9a+c=3b,则可判断n=3 | |
| D. | 若n=2,则Ⅱ体系起始物质的量应满足1<b<3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com