
分析 (1)发生酯化反应生成乙酸乙酯和水;
(2)工业冶炼镁是电解氯化镁;
(3)二氧化硅与氢氟酸反应,生成四氟化硅气体和水;
(4)铁离子和亚硫酸根离子的氧化还原反应,铁离子得电子被还原,亚硫酸根离子失电子被氧化;
(5)火法炼铜原理为:高温下将硫化亚铜与氧气反应生成二氧化硫和铜.
解答 解:(1)发生酯化反应生成乙酸乙酯和水,反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(2)工业冶炼镁是电解氯化镁,化学方程式为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
(3)二氧化硅可以和唯一的酸HF之间反应生成四氟化硅和水,反应方程式为:SiO2+4HF=SiF4↑+2H2O,
故答案为:SiO2+4HF=SiF4↑+2H2O;
(4)铁离子和亚硫酸根离子的氧化还原反应,铁离子得电子被还原,亚硫酸根离子失电子被氧化,离子反应方程式为:2Fe3++SO32-+1H2O=2Fe2++SO42-+2H+,故答案为:2Fe3++SO32-+1H2O=2Fe2++SO42-+2H+;
(5)火法炼铜原理为:高温下将硫化亚铜与氧气反应生成二氧化硫和铜,方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2,故答案为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
点评 本题考查了化学方程式的书写,侧重元素化合物知识的考查,把握反应物、生成物及化学反应遵循质量守恒定律为解答的关键,题目难度不大,注意掌握化学方程式的书写方法.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4OH--4e-═O2↑+2H2O | B. | Zn--2e-?Zn 2+ | ||
| C. | O2+2H2O+4e-═4OH- | D. | 2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种溶液的pH的大小顺序是①>②>③ | |
| B. | 三种溶液稀释相同倍数,pH变化最大的是① | |
| C. | 三种溶液中含微粒种类多少顺序是:②>①>③ | |
| D. | 三种溶液中由水电离出c(H+)大小顺序是:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能源大部分是由化学反应产生的 | |
| B. | 煤,石油,天然气是当今世界最重要的三种化石燃料 | |
| C. | 最理想的能源是煤炭 | |
| D. | 人体运动所消耗的能量与化学反应有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
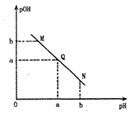 某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=-lgc(OH-)]与 pH 的变化关系如,图所示,则( )
某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加人等浓度的NaOH溶液,溶液中 pOH[pOH=-lgc(OH-)]与 pH 的变化关系如,图所示,则( )| A. | M点所示溶液的导电能力强于Q点 | |
| B. | N 点所示溶液中 c(CH3COO-)>c(Na+) | |
| C. | Q点消耗NaOH溶液的体积等于醋酸溶液的体积 | |
| D. | M点和N点所示溶液中水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com