
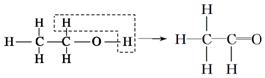
| A. | 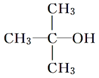 | B. |  | C. | 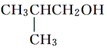 | D. | 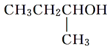 |
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
 在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:
在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | 0.040 | 0.040 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙显红色的溶液中:Na+、K+、Cl-、ClO- | |
| B. | 滴入KSCN显血红色的溶液中:Na+、Mg2+、SO42-、Br- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1012mol/L的溶液中:K+、Na+、NO3-、HCO3- | |
| D. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 和 NaOH 含有相同类型的化学键 | |
| B. | 具有还原性是因为其中的钠元素还原性强 | |
| C. | 熔融状态的硼氢化钠能导电 | |
| D. | 硼氢化钠与盐酸混合:NaBH4+HCl+3H2O═H3BO3+NaCl+4H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
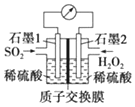 正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.
正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、炭黑、多糖、无机盐 | B. | 塑料、煤炭、多糖、无机盐 | ||
| C. | 多糖、炭黑、蛋白质、无机盐 | D. | 蛋白质、煤炭、多糖、有机玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②③④⑦ | D. | ④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1的FeCl3溶液中Fe3+的数目为NA | |
| B. | 32g甲烷中含有2NA个C-H键 | |
| C. | 1molNH2-含有10NA个电子 | |
| D. | 1molNa2O2与足量CO2反应.转移电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com