
| A. | 1L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 标准状况下,11.2 LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA | |
| D. | 室温下,将9g铝片投入0.5L18.4mol•L-1的H2SO4中,转移的电子数为NA |
分析 A、在偏铝酸钠溶液中,除了偏铝酸钠,水也含氧原子;
B、11.2LNO与11.2LO2混合后发生的反应为2NO+O2═2NO2,2NO2 N2O4;
N2O4;
C、氧化钠和过氧化钠均由2个钠离子和1个阴离子构成;
D、室温下,铝在浓硫酸中会钝化.
解答 解:A、在偏铝酸钠溶液中,除了偏铝酸钠,水也含氧原子,故溶液中的氧原子的个数多于2NA个,故A错误;
B、11.2LNO与11.2LO2混合后发生的反应为2NO+O2═2NO2,2NO2 N2O4,则反应后的气体的物质的量小于0,75mol,分子个数小于0.7NA个,故B错误;
N2O4,则反应后的气体的物质的量小于0,75mol,分子个数小于0.7NA个,故B错误;
C、氧化钠和过氧化钠均由2个钠离子和1个阴离子构成,故1mol两者的混合物中含有的阴离子为NA个,故C正确;
D、室温下,铝在浓硫酸中会钝化,故反应程度很小,则转移的电子数小于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
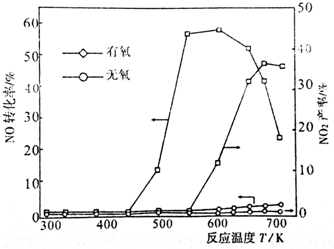
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 946kJ/mol | B. | 896kJ/mol | C. | 649kJ/mol | D. | 431kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
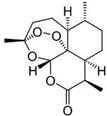
| A. | 化学是以实验为基础的一门学科,定量研究方法是化学发展为一门独立学科的重要标志之一 | |
| B. | 燃煤脱硫、汽车中加装尾气处理装置、利用二氧化碳制造全降解塑料、推广新能源汽车都能有效减少环境污染 | |
| C. | 我国科学家屠呦呦发现的青蒿素(结构见图),其中有类似于H2O2的结构,因此遇到强还原性的物质会变质 | |
| D. | 利用氢氧化铁胶体的“丁达尔效应“,可以除去水中的悬浮颗粒,从而达到净水的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入 碳粉一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按下图所示组装实验装置,一段时间后,测定NO3-浓度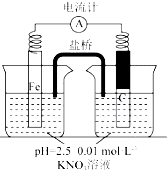 | Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
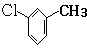
| A. | 该烃分子内既有碳碳双键又有碳碳三键 | |
| B. | 该烃分子内碳原子数超过6 | |
| C. | 该烃能发生氧化反应和加聚反应 | |
| D. | 化合物B有两种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
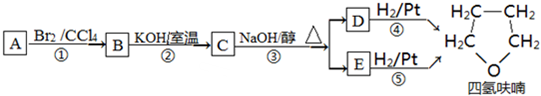
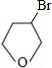 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$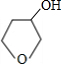 +NaBr.
+NaBr.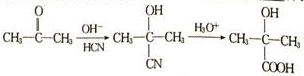 ,根据提示的信息,模仿以下提示的流程图设计合成路线,以苯酚为主要原料合成
,根据提示的信息,模仿以下提示的流程图设计合成路线,以苯酚为主要原料合成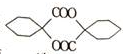 ,标明每一步的反应物及反应条件(有机物写结构简式,其它原料自选)
,标明每一步的反应物及反应条件(有机物写结构简式,其它原料自选)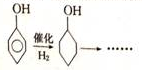
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.
,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.  ),下列有关G的叙述正确的是B.(填选项)
),下列有关G的叙述正确的是B.(填选项)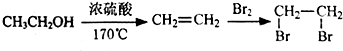
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
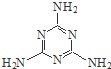 密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )
密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )| A. | 17:44 | B. | 22:17 | C. | 17:22 | D. | 2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com