
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
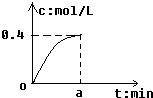 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 0.1 | B. | 2.5 | C. | 5 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤⑥ | B. | ①⑤ | C. | ②③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
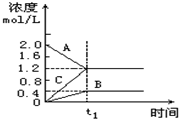 在一定的温度和容积为l L的密闭容器中投入A、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是( )
在一定的温度和容积为l L的密闭容器中投入A、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是( )| A. | t1时刻之后,若再加入一定量的A,达平衡时A的转化率降低 | |
| B. | t1时刻之后,3v(A)逆=2v(C)正 (v-速率) | |
| C. | t1时刻之后,若升高温度,混合气体的平均摩尔质量增大,则该反应A消耗的方向为吸热反应 | |
| D. | 在温度和容积固定不变的条件下,起始投入1molB、3molC达平衡时A的体积分数为3/7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(KOH)=n(KHCO3) | B. | n(KOH)<n(KHCO3) | C. | n(KOH)>n(KHCO3) | D. | KOH、KHCO3任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0℃ |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com