
| A. | 羟基的电子式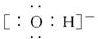 | B. | CH4分子的球棍模型 | ||
| C. | 乙烯的最简式(实验式) CH2 | D. | 苯乙醛结构简式 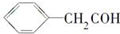 |
分析 A.羟基为中性原子团,氧原子最外层电子数为7;
B. 是甲烷的比例模型,不是球棍模型;
是甲烷的比例模型,不是球棍模型;
C.最简式为分子中各原子个数的最简比;
D.苯乙醛中醛基的表示方法错误.
解答 解:A.羟基中存在一个碳氧共用电子对,羟基的电子式为 ,故A错误;
,故A错误;
B. 为甲烷的比例模型,甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为:
为甲烷的比例模型,甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为: ,故B错误;
,故B错误;
C.乙烯的分子式为CH2=CH2,则其最简式(实验式)为:CH2,故C正确;
D.苯乙醛分子中含有1个醛基,苯乙醛正确的结构简式为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握常见化学用语的概念及书写原则,明确羟基与氢氧根离子的区别,试题有利于提高学生的规范答题能力.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:推断题
 回答下列问题:
回答下列问题: ,乙的电子式为
,乙的电子式为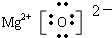 .
.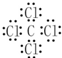 ,乙的化学式为NaCl.
,乙的化学式为NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
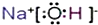 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
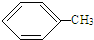 +3HO-NO2$\stackrel{浓硫酸}{→}$
+3HO-NO2$\stackrel{浓硫酸}{→}$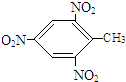 +3H2O.
+3H2O. .
.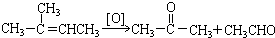
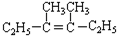 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
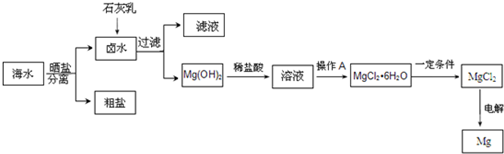
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 3 | C. | 2 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、H2、C2H6 | B. | H2O、CO2、H2SO4 | C. | SO2、SiO2、P2O5 | D. | CCl4、SiC、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤干馏可以提高能源的利用率 | |
| B. | 甲烷也是一种温室气体,应禁止使用天然气 | |
| C. | 锌-锰干电池是对环境没任何污染的理想电池 | |
| D. | 寻找高效催化剂,使二氧化硅分解产生硅的同时释放能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | Y、Z、W、A元素性质均较为活泼,但其中Y、W在自然界中存在游离态的形式,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阳离子交换膜,其阴极反应式为:2H2O+2e-═2OH-+H2↑ | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2W3具有氧化性和还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com