
【题目】下列说法正确的是( )
A.若丙醇中的氧为188O,它与乙酸反应生成的酯的相对分子质量是104
B.用乙酰水杨酸![]() 与适量NaOH溶液反应制备
与适量NaOH溶液反应制备![]()
C.向柠檬醛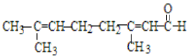 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基
中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基
D.![]() 、
、![]() 、
、![]() 三种氨基酸脱水,最多可生成 6种二肽。
三种氨基酸脱水,最多可生成 6种二肽。
【答案】A
【解析】
试题分析:A.丙醇中的氧为18O,其相对分子质量为62,乙酸的相对分子质量为60,水的相对分子质量为18,由质量守恒定律可知,酯的相对分子质量为62+60-18=104,故A正确;B.乙酰水扬酸![]() 与适量NaOH溶液反应生成的是
与适量NaOH溶液反应生成的是![]() ,故B错误;C.
,故B错误;C.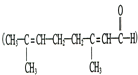 分子中含有碳碳双键和醛基,碳碳双键和醛基都能够与酸性高锰酸钾溶液反应,溶液褪色,不能说明分子中含有醛基,可以通过银镜反应进行检验醛基,故C错误;D.
分子中含有碳碳双键和醛基,碳碳双键和醛基都能够与酸性高锰酸钾溶液反应,溶液褪色,不能说明分子中含有醛基,可以通过银镜反应进行检验醛基,故C错误;D.![]() 三种氨基酸脱水,相同的氨基酸分子内脱水可以生成二肽,三种氨基酸总共有三种分子内脱水生成的二肽;不同的氨基酸之间也可以形成二肽,每两种氨基酸可以形成两种二肽,三种氨基酸可以通过分子间脱水形成6种二肽,所以三种不同的氨基酸最多可生成9种二肽,故D错误;故选A。
三种氨基酸脱水,相同的氨基酸分子内脱水可以生成二肽,三种氨基酸总共有三种分子内脱水生成的二肽;不同的氨基酸之间也可以形成二肽,每两种氨基酸可以形成两种二肽,三种氨基酸可以通过分子间脱水形成6种二肽,所以三种不同的氨基酸最多可生成9种二肽,故D错误;故选A。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2=2CO2 +3H2O,电池示意图如下,下列说法中正确的是

A.b极为电池的负极
B.电池工作时电子在内电路中由a极经溶液到b极
C.电池负极的电极反应为:C2H5OH+3H2O-12e-=2CO2+12H+
D.电池工作时,1mol乙醇被氧化时有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示反应N2(g)+3H2(g)![]() 2NH3(g); ΔH=-92.2kJ/mol。 在某段时间t0~ t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( )
2NH3(g); ΔH=-92.2kJ/mol。 在某段时间t0~ t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( )

A、t0—t1 B t2—t3 C t3—t4 D t5—t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,书写正确的是
A.碳酸氢钠溶液与氢氧化钠溶液反应:H++OH-=H2O
B.铝与烧碱溶液反应:Al+2H2O+OH-=AlO2-+ 2H2↑
C.碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
D.向偏铝酸钠溶液中通入少量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2均是重要的化工原料,CO2的固定和利用对环境保护及能源开发具有重要的意义。
(1)利用水煤气(CO+H2)作为合成气,在同一容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚(CH3OCH3)。
甲醇合成反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.8kJ·mol-1
CH3OH(g) △H1=-90.8kJ·mol-1
水煤气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.3kJ·mol-1
CO2(g)+H2(g) △H2=-41.3kJ·mol-1
甲醇脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
写出由CO和H2合成二甲醚气体和水蒸气的热化学方程式____________。
(2)在2L恒容密闭容器中,投入CO(g)和H2(g)各5mol,发生如下反应:
3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:

①p1、p2、p3中最大的是________。
②若该反应进行50min时达到平衡,此时CO的转化率α=0.6,则50min内H2的反应速率为____mol·L-1·min-1。
(3)二甲醚(CH3OCH3)燃料电池具有启动快。效率高等优点,其能量密度高于甲醇燃料电池。其工作原理如图所示。X极附近的酸性______(填“减弱”、“增强”或“不变”),Y电极是_____极,写出X电极上发生的电极反应式__________。若用该二甲醚燃料电池电解饱和食盐水(阳极为石墨电极),当有2.3g燃料被消耗时,阴极产生气体的体积为_____L(标准状况下)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的有
①乙酸的最简式:CH2O
②二氧化硅的分子式:SiO2
③HClO的结构式:H—Cl—O
④乙烯是结构简式:CH2CH2
⑤Cl-的结构示意图:
⑥过氧化钠的电子式:![]()
⑦H2CO3的电离方程式:H2CO3![]() H++HCO3-
H++HCO3-
⑧吸氧腐蚀的正极反应:O2+4e-+4H+=2H2O
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com