
| A. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸上 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 称氢氧化钠时,不能直接称量,要放在纸片上称量 |
分析 A.过滤时要防止滤纸破损;
B.从蒸馏时温度计的作用的角度考虑;
C.分液时要避免液体重新混合而污染;
D.氢氧化钠易潮解,应该放入烧杯中称量.
解答 解:A.过滤时要防止滤纸破损,玻璃棒的末端应轻轻靠在三层的滤纸上,故A正确;
B.蒸馏时,温度计用来测量馏分的温度,应靠近蒸馏烧瓶的支管口处,故B正确;
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,可防止液体重新混合而污染,故C正确;
D.氢氧化钠具有腐蚀性、易潮解,称氢氧化钠时,不能放在纸片上称量,应该放入烧杯中快速称量,故D错误;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及过滤、蒸馏、分液及称量等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 615 | 413 | 436 |
| n(CO2)/n(C3H8)温度/K | 600 | 700 | 800 | 900 | 1000 |
| 0:1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1:1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1:2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1:3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2>I->Fe2+>Cl- | B. | I->Fe2+>Cl->SO2 | C. | Cl->Fe2+>SO2>I- | D. | Fe2+>I->Cl->SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气与11.2LNH3含有的原子数相同 | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA | |
| D. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
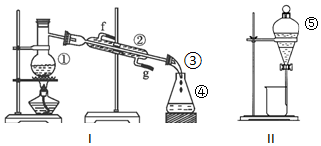
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
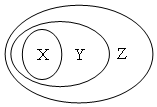 用下图表示的一些物质或概念间的从属关系中不正确的是( )
用下图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 氯化钠 | 电解质 | 化合物 |
| C | 金属氧化物 | 碱性氧化物 | 氧化物 |
| D | 牛奶 | 胶体 | 分散系 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | |
| 分类标准 | 含氧酸 | 分散系 | (3)硝酸盐 |
| 不属于该类别的物质 | (1)HCl | (2)水 | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | B. | c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(HS-)+c(S2-)+c( H2S) | D. | c(HS-)+c(S2-)+c(H2S)=1.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com