
【题目】下列基团:﹣CH3、﹣OH、﹣COOH、﹣C6H5,相互两两组成的具有酸性的有机物有( )
A. 1种 B. 2种 C. 3种 D. 4种
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】POCl3广泛用于染料等工业。某化学学习小组借助拉瓦锡研究空气成分的曲颈甑(装置甲)合成PC13,并采取PCl3氧化法制备POCl3。
已知:(1)PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;
(2)2PCl3+O2==2POCl3。
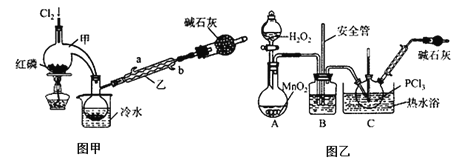
【实验Ⅰ】图甲制备PCl3
(1)实验室制备Cl2的反应方程式是_______________;
(2)碱石灰的作用除了处理尾气外还有_______________。
【实验Ⅱ】图乙制备POCl3
(3)装置B的作用除了干燥O2外,还有________________________;
(4)C中反应温度控制在60~65℃,其原因是________________________。
【实验Ⅲ】测定POCl3含量
①准确称取30.70gPOC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+为指示剂,用0.2000mol/LKSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。 已知:Ag++SCN-==AgSCN↓ Ksp(AgCl)>Ksp(AgSCN)。
(5)POC13水解的化学反应方程式为________________________。
(6)滴定终点的现象为____________,用硝基苯覆盖沉淀的目的是________________________。
(7)反应中POC13的百分含量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的名称或化学式:
A(名称):_________E(名称):_________J(化学式):_________G(化学式):_________;
(2)按要求写方程式:
D转化为E的离子方程式:________________________________________________;
F在空气中转化为G的化学方程式:________________________________________;
电解C可以得到单质B,试写出B生成I的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。某学生拟用下图装置做草酸晶体的分解实验并验证部分产物,下列说法错误的是
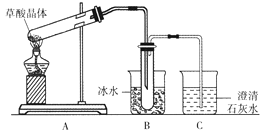
A. 装置A中的大试管口应略向下倾斜,是因为加热草酸晶体时会产生水
B. 装置B的主要作用是冷凝(水蒸气、草酸)等,防止草酸进入装置C中,干扰CO2的检验
C. 装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
D. 本实验能证明草酸晶体的分解产物有二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A. 溴化铵的电子式:  B. 次氯酸分子的结构式:H-O-Cl
B. 次氯酸分子的结构式:H-O-Cl
C. 氨气分子的电子式:  D. 氯化钠的分子式:NaCl
D. 氯化钠的分子式:NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、F、Ca是六种重要的元素请根据所学的物质结构与性质的4机关知识下列问题:
(1)基态碳原子的电子排布式为__,O和F形成的化合物中原子价层都满足8电子结构的结构式是__,O元素的化合价为________.
(2)Ca在燃烧时产生红色火焰,其焰色反应看见的光属于__(填“吸收”或“发射”)光谱。
(3)某药物的结构简式为![]() ,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
(4)CO2属于_____(填“极性”或”非极性”)分子。CO32-的空间构型为_____,与其互为等电子体的分子和离子分别为_________(各写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①SO2②SO3③SO32-④SO42-四种粒子,回答下列问题:
(1)其中中心原子S的杂化方式为sp2的是__(填序号,下同);中心原子S的杂化方式为sp3的是_________.
(2)SO2在水中的溶解度比较大,原因是_____________。
(3)下列对H2SO3和H2SO4的说法正确的是_____(填字母)。
A.H2SO4比H2SO3易电离出H+是因为H2SO4分子中的非羟基氧多
B.H2SO4比H2SO3易电离出H+是因为H2SO4分子中中心原子S的孤电子对少
C.在H2SO4溶液中存在的粒子的空间构型有V形和正四面体形
(4)若丁二烯CH2=CH-CH=CH2中除含σ键外,还含有一个Π44键(Πmn键表示n个原子、m个电子组成的大п键),SO2含有大п键,可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) B. c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-)
C. c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-) D. ![]() <1.0×10-7mol/L
<1.0×10-7mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com