
电镀厂镀铜废水中含有CN-和Cr2O72-,需要处理达标后才能排放。该厂拟定下列流程进行废水处理:
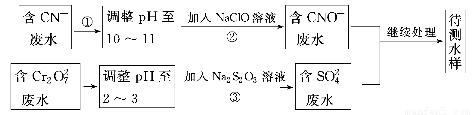
回答下列问题:
(1)上述处理废水流程中主要使用的方法是________。
(2)②中反应后无气体放出,该反应的离子方程式为______________________________
__________________________________。
(3)步骤③中,每处理0.4 mol Cr2O72-时转移电子2.4 mol,该反应的离子方程式为________________________________________________________________________。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因:
________________________________________________________________________。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O,将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入a mol FeSO4·7H2O,下列结论正确的是________。
A.x=0.5,a=8 B.x=0.5,a=10
C.x=1.5,a=8? D.x=1.5,a=10
(1)氧化还原法
(2)CN-+ClO-=CNO-+Cl-
(3)3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O
(4)Cu2++2OH-=Cu(OH)2↓、Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq),因为Ksp(CuS)<Ksp[Cu(OH)2]
(5)D
【解析】(1)废水的处理方法有沉淀法、吸咐法、中和法、混凝法、氧化还原法等。由上述流程图中反应②和反应③加入的试剂并对比反应前后的物质,可以发现两个反应均为氧化还原反应,故上述处理废水的主要方法是氧化还原法。(2)反应物为CN-和NaClO,生成物有CNO-,即CN-生成CNO-,相当于C由+2价升高至+4价,那么根据氧化还原反应得失电子守恒可知,ClO-在反应中元素化合价降低,题目提示无气体生成,故其中的+1价Cl转化为Cl-,因此离子方程式为CN-+ClO-=CNO-+Cl-。(3)由反应物S2O32-转化为生成物SO42-可知,Cr2O72-被还原,其中Cr元素化合价降低,设Cr2O72-被还原后Cr的化合价为+n,则有关系:1∶2×(6-n)=0.4∶2.4,所以n=3,即Cr2O72-被还原为Cr3+,因此该反应的离子方程式为3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O。(4)先生成Cu(OH)2沉淀,加入Na2S后,Cu(OH)2沉淀转化为CuS沉淀。这是因为Cu(OH)2的溶解度比CuS的溶解度大,或者说Cu(OH)2的溶度积大于CuS的溶度积,难溶的电解质转化为更难溶的电解质。(5)生成铁氧磁体的物质的量为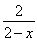 mol,根据得失电子守恒有
mol,根据得失电子守恒有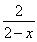 ×x=6,得x=1.5,a=
×x=6,得x=1.5,a=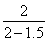 ×(1+1.5)=10。
×(1+1.5)=10。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com