
下列说法中正确的是( )
A.二氧化硫溶于水能导电,故二氧化硫属于电解质
B.硫酸钡难溶于水,故硫酸钡属于弱电解质
C.硫酸是强电解质,故纯硫酸能导电
D.氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同
科目:高中化学 来源: 题型:
苹果酸的结构简式为HOOC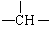 CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A.苹果酸中能发生酯化反应的官能团有2种
B.1mol苹果酸可与3mol NaOH发生中和反应
C.1mol苹果酸与足量金属Na反应生成生成1mol H2
D.HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以缓慢结合的方式进行的,具有
高度特异性,其分子结构如下所示。
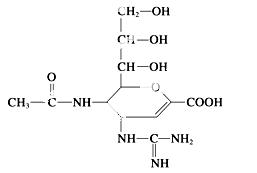
下列说法正确的是 ( )
A.该物质的分子式为C12H19N4O7
B.1 mol该物质与NaOH溶液反应,可以消耗4 mol NaOH
C.在一定条件下,该物质可以发生消去、加成、取代等反应
D.该物质能使溴水或酸性高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列涉及的有机物及有机反应类型错误的是
A.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应
B.酯、蛋白质、纤维素都能发生水解反应
C.苯、乙醇和乙酸都能发生取代反应
D.1 mol乙醇与1 mol乙酸在一定条件下,发生酯化反应可生成1 mol乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.1 | 粉末 | 0. 8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 |
| 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
分析上述数据,回答下列问题:
(1) 实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规律另一组实验是___________(填实验序号)。
(2) 在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有________(填实验序号)。
(3) 本实验中影响反应速率的其他因素还有_________,其实验序号是_____。
(4) 实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种情况下一定能大量共存的离子组为( )
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO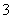
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO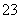 、Cl-、K+
、Cl-、K+
C.pH=1的溶液中:NH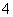 、Cl-、Cu2+、SO
、Cl-、Cu2+、SO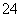
D.无色溶液中:Al3+、HCO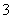 、I-、K+
、I-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
有关①100mL 0.1mol/L NaHCO3 ②100mL 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO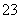 )>c(H2CO3)
)>c(H2CO3)
D.②溶液中:c(HCO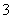 )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数约为6.02×1023 mol-1,下列说法正确的是( )
A.2.3 g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023
B.标准状况下,22.4 L乙醇的共价键数为8×6.02×1023
C.标准状况下,5.6 L甲醛所含的电子数为4×6.02×1023
D.100 mL 1 mol·L-1醋酸溶液中,H+的个数为0.1×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______________________________________________________________。
(2)已知:甲醇脱水反应 2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应 2CH3OH(g)===C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1
乙醇异构化反应 C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________kJ·mol-1。与间接水合法相比,气相直接水合法的优点是__________________________。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n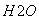 :n
:n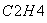 =1:1]
=1:1]
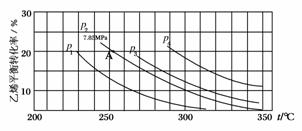
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强p1、p2、p3、p4的大小顺序为:________,理由是:______________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9 MPa,n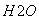 :n
:n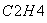 =0.6:1。乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:________________、________________。
=0.6:1。乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:________________、________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com