
| A. | 若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 | |
| B. | 氢化锂也是一种储氢材料,供氢原理为LiH+H2O═LiOH+H2↑ | |
| C. | 生成等质量的氢气,反应①、②转移电子数之比为4:3 | |
| D. | LiAlH4是共价化合物,LiH是离子化合物 |
分析 A、状态不知,无法由体积求物质的量;
B、氢化锂中的氢是-1价,与水发生归中反应,方程式为:LiH+H2O═LiOH+H2↑;
C、LiAlH4中的Li、Al都是主族金属元素,H是非金属元素,故Li为+1价、Al为+3价、H为-1价,受热分解时,根据Al元素的价态变化即可得出1 mol LiAlH4在125℃时完全分解,转移3 mol电子,生成1.5mol的氢气,而LiAlH4+2H2O═LiAlO2+4H2↑生成4mol的氢气转移4mol的电子,所以生成1mol的氢气转移电子分别为:2mol和1mol;
D、LiAlH4是离子化合物,LiH是离子化合物.
解答 解:A、状态不知,无法由体积求物质的量,故A错误;
B、氢化锂中的氢是-1价,与水发生归中反应,方程式为:LiH+H2O═LiOH+H2↑,所以氢化锂也是一种储氢材料,故B正确;
C、LiAlH4中的Li、Al都是主族金属元素,H是非金属元素,故Li为+1价、Al为+3价、H为-1价,受热分解时,根据Al元素的价态变化即可得出1 mol LiAlH4在125℃时完全分解,转移3 mol电子,生成1.5mol的氢气,而LiAlH4+2H2O═LiAlO2+4H2↑生成4mol的氢气转移4mol的电子,所以生成1mol的氢气转移电子分别为:2mol和1mol,所以反应①、②转移电子数之比为1:1,故C错误;
D、LiAlH4是离子化合物,LiH是离子化合物,故D错误;
故选B.
点评 本题考查了氧化还原反应、元素化合物性质,侧重考查氢化锂的性质,熟悉氢化锂中氢为-1价是解题关键,注意对所给条件的分析和应用,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y<W<Z | |
| B. | 由 W与Y组成的分子都是非极性分子 | |
| C. | 由 Z与Y组成的化合物都能与水反应 | |
| D. | X与氢元素组成的化合物的沸点都低于Y与氢元素组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2015年诺贝尔化学奖颁给了研究细胞修复自身DNA机制的三位科学家.DNA属于有机高分子,化学家鲍林(L.Pauling)提出的氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 | |
| B. | 生物炼铜是指铜矿石在细菌作用下可把不溶性的硫化铜转化为可溶性铜盐,使铜的冶炼变得简单 | |
| C. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 扫描隧道显微技术、超分辨荧光显微技术等的发展促进了人类对微观结构的探索,可实现对原子或分子的操控,使科学研究迈入更高的水平层次 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| B. | 丙烯的比例模型为: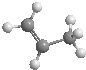 | |
| C. | 1mol物质: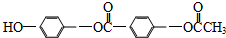 最多能与3mol NaOH反应 最多能与3mol NaOH反应 | |
| D. | CH3CN的电子式为: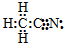 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
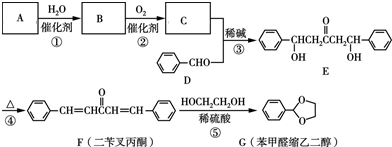
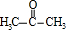 +2
+2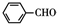 $\stackrel{碱}{→}$
$\stackrel{碱}{→}$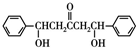 .
.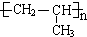 .
.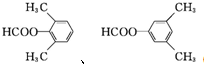 .
. (无机物任选).
(无机物任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg$→_{点燃}^{CO_{2}}$C$→_{△}^{H_{2}SO_{4}(浓)}$SO3 | |
| B. | 0.1mol•L-1HCl$→_{△}^{MnO_{2}}$Cl2$\stackrel{石灰水}{→}$Ca(ClO)2(aq) | |
| C. | NaCl饱和溶液$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | 淀粉溶液$→_{△}^{稀硫酸}$葡萄糖$→_{△}^{Cu(OH)_{2}悬浊液}$Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油的分馏、煤的干馏均是物理变化 | |
| B. | 应当大力实施矿物燃料“脱硫“、脱硝技术”,减少硫的氧化物和氮氧化物的污染 | |
| C. | 近期我国华北地区出现雾霸天气,PM2.5超标.PM2.5仅来自煤的燃烧 | |
| D. | 根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
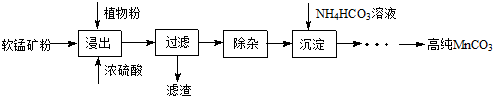
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com