
【题目】下列图示与对应的叙述不相符的是( )
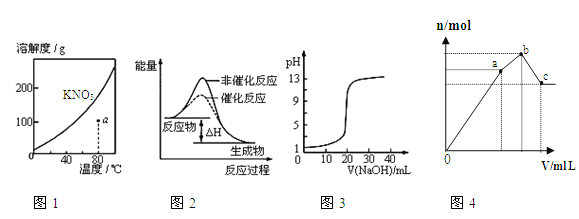
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
【答案】C
【解析】
试题分析:A、KNO3的溶解度随着温度的升高而升高,溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,A正确;B、反应物的总能量大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,B正确;C、0.1000molL-1NaOH溶液滴定20.00mL 0.1000molL-1CH3COOH溶液,消氢氧化钠溶液体积为0时,醋酸为弱电解质,醋酸溶液的pH大于1,图像中醋酸的pH=1与实际不符,C错误;D、开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(b到c),D正确,但选C。


科目:高中化学 来源: 题型:
【题目】北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢,则钒原子的价电子排布式正确的是( )
A. 3s23p6B. 3d34s2C. 3d64s2D. 4s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关描述正确的个数是( )
①甲苯分子中的所有原子可能共平面 ②苯乙烯![]() 中的所有原子可能共平面
中的所有原子可能共平面
③二氯甲烷分子为正四面体结构 ④乙烷分子中的所有原子不可能都在同一平面内
⑤甲烷分子中的4个氢原子全部被苯基取代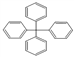 ,其分子内的所有碳原子可能共平面
,其分子内的所有碳原子可能共平面
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的尿路感染、皮肤软组织感染以及急性扁桃体炎、急性咽炎、中耳炎和肺部感染等的治疗。已知肽键可以在碱性条件下水解。下列对头孢羟氨苄的说法中正确的是
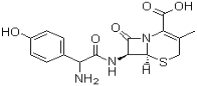 ·H2O
·H2O
A.头孢羟氨苄的化学式为C16H16N3O5S·H2O
B.1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol
C.在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2
D.头孢羟氨苄能在空气中稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解尿素[CO(NH2)2]是一种能耗很低的制氢方法,其工作原理如图所示,总反应为CO(NH2)2+2OH-![]() N2↑+3H2↑+CO32-。下列说法错误的是
N2↑+3H2↑+CO32-。下列说法错误的是

A. 阴极的材料可选择钢铁制品
B. 电解池工作时,阳极区域溶液的pH减小
C. 阳极的电极反应式为CO(NH2)2+8OH--6e-==N2↑+ CO32-+6H2O。
D. 若电路中通过3 mol 电子,则生成气体的总体积为33. 6L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作不能用于检验NH3的是
A.气体使湿润的酚酞试纸变红 B.气体能使湿润的红色石蕊试纸变蓝
C.气体与蘸有浓H2SO4的玻璃棒靠近 D.气体与蘸有浓盐酸的玻璃棒靠近
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀产生的工业废水含有的重金属离子(Cu2+、Ni2+等)和CN形成难以除去的络合物,用电解法制备高铁酸钠(Na2FeO4)处理废水是目前比较先进的方法。已知氰化氢有毒易挥发。电解装置如图所示,下列选项正确的是( )
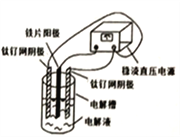
A. 铁片连接电源的负极
B. 电解时,每生成lmolFeO42-,转移电子3mol
C. CN被氧化成CO2和N2,Cu2+、Ni2+形成难溶碱而除去
D. 已知HFeO4-的氧化性比FeO42-更强,故pH<7时处理废水效率更高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com