
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g) + H2(g) ΔH1已知:②C4H10(g) +![]() O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) +
O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) + ![]() O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是______________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。590 ℃之后,丁烯产率快速降低的主要原因是_____________。
【答案】+123 小于 AD 氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大,故丁烯产率下降 丁烯高温裂解生成短链烃类
【解析】
本题考查的是用盖斯定律进行有关反应热的计算、化学平衡的影响因素。
①根据盖斯定律,②式-③式可得①式的△H1;
②由图(a)定温度,压强由0.1MPa变化到xMPa,丁烷的转化率增大,即平衡正向移动,结合反应前后气体体积的变化分析x;
③要使丁烯的平衡产率增大,需通过改变温度和压强使平衡正向移动;丁烷分解产生丁烯和氢气,增加氢气的量会促使平衡逆向移动,丁烯的产率下降;由题中信息可知丁烷高温会裂解生成短链烃类,所以当温度超过590℃时,部分丁烷裂解导致产率降低。
(1)②C4H10(g)+1/2O2(g)=C4H8(g)+H2O(g)△H2=119kJmol1
③H2(g)+1/2O2(g)=H2O(g)△H3=242kJmol1
②③得C4H10(g)=C4H8(g)+H2(g)△H1=+123kJmol1;
由图(a)可知温度相同时,由0.1MPa变化到xMPa,丁烷转化率增大,即平衡正向移动,该反应是气体体积增大的反应,所以x的压强更小,x<0.1; 由于反应①为吸热反应,温度升高时,平衡正向移动,丁烯的平衡产率增大,反应①正向进行时体积增大,减压时平衡正向移动,丁烯的平衡产率增大,因此AD正确。本小题答案为:+123;小于;AD。
(2)丁烷分解产生丁烯和氢气,一开始充入氢气是活化催化剂,同时氢气作为反应①的产物,增大氢气的量会促使平衡逆向移动,从而减少平衡体系中的丁烯的含量,使丁烯的产率降低。本小题答案为:氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大,故丁烯产率下降。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。温度超过590℃时,由于丁烷高温会裂解生成短链烃类,所以参加反应①的丁烷也就相应减少,产率下降。本小题答案为:丁烯高温裂解生成短链烃类。


科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和K2SO4溶液。下列说法正确的是( )

A. b电极上发生还原反应
B. 外电路电流方向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为MnO4-+8H++5e-=Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_______吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在__________(填离子符号),检验溶液中还存在Fe2+的方法是_____________________________(注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为________________________.
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_________.
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩10种元素在周期表中的位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,最不活泼的是(填元素符号,下同)________,金属性最强的是________,③④⑤三种元素的原子半径由大到小的顺序是________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式,下同),呈两性的氢氧化物是________。
(4)比较⑥和⑦氢化物的稳定性由强到弱的顺序是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. (1)用锌片,铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气________L(标准状况下),导线中通过________mol电子。
(2) 将ag Na投入到bg D2O(足量)中,反应后所得溶液的密度为dg/cm3,则该溶液物质的量浓度是_______;
Ⅱ. 将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g)。反应进行到10 s末时,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
(1)用C表示10 s内正反应的平均反应速率为____________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列
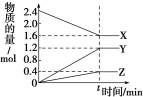
表述中正确的是
A.反应的化学方程式为2X = 3Y + Z
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干AlCl3溶液得到Al2O3固体
A. ①②③ B. ②③④⑤ C. ②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A. 11.2gB. 5.6gC. 2.8gD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O5是常用的防腐剂和漂白剂。可利用烟道气中的SO2生产Na2S2O5,其流程如下:
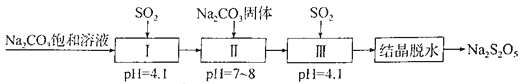
下列说法正确的是
A. 上述制备过程所涉及的物质中只有一种酸性氧化物
B. Na2S2O5作防腐剂和SO2作漂白剂时,均表现还原性
C. 上述流程中的Na2CO3饱和溶液和Na2CO3固体不可互换
D. 实验室模拟“结晶脱水”时用到的仪器只有蒸发皿、玻璃棒、烧杯、漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com