
| A. | N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=+534 kJ•mol-1 | |
| B. | N2H4(l)+O2(g)═N2(g)+2H2O(g);△H=-534 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-534 kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-622 kJ•mol-1 |
分析 先计算出1molN2H4(气态)完全反应生成N2(气态)和H2O(气态)放出的热量,然后写出该反应的热化学方程式,再结合H2O(g)=H2O(l)△H=-44KJ.mol-1利用盖斯定律计算出1molN2H4(气态)完全反应生成N2(气态)和H2O(液态)的热化学方程式,最后对各选项进行判断即可.
解答 解:0.1mol N2H4(气态)在O2(气态)中燃烧生成N2(气态)和H2O(气态),则1mol N2H4(气态)完全反应生成N2(气态)和H2O(气态)放出的热量为:53.4kJ×$\frac{1mol}{0.1mol}$=534kJ,该反应的热化学方程式为:①N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534 kJ•mol-1,故A、B错误;
又知②H2O(g)=H2O(l)△H=-44KJ.mol-1,
根据盖斯定律,①+②×2可得:N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-622 kJ•mol-1,故C错误、D正确;
故选D.
点评 本题考查了热化学方程式书写、盖斯定律的应用,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握热化学方程式的概念及书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 生理盐水的浓度为0.9% | |
| B. | 阿司匹林具有解热镇痛的作用 | |
| C. | 垃圾是放错地方的资源,应分类回收利用 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,Ag2O为负极 | |
| B. | 如果有1mol电子转移,就有32.5g Zn参加反应 | |
| C. | 原电池工作时,正极区PH减小 | |
| D. | 锌为阳极,Ag2O为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 (R、R′可以是氢原子、烃基或官能团)
(R、R′可以是氢原子、烃基或官能团) .
. .
. .
.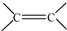 和
和 结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任两种).
结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任两种).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容量瓶中原有少量蒸馏水 | B. | 溶解所用的烧杯未洗涤 | ||
| C. | 定容时仰视观察液面 | D. | 定容时俯视观察液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
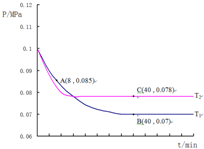 2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com