
按要求书写电极反应式和总方程式
(1)用惰性电极电解AgNO3溶液:
阳极反应式___________________________________________________;
阴极反应式____________________________________________________;
总反应离子方程式______________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式____________________________________________________;
阴极反应式____________________________________________________;
总反应离子方程式_______________________________________________。
(3)用铁作电极电解NaCl溶液
阳极反应式_____________________________________________________;
阴极反应式_____________________________________________________;
总反应化学方程式_______________________________________________。
(4)用铁作电极电解NaOH溶液
阳极反应式______________________________________________________;
阴极反应式_______________________________________________________;
总反应离子方程式_________________________________________________。
(5)用铜作电极电解盐酸溶液
阳极反应式_________________________________________________________;
阴极反应式_________________________________________________________;
总反应离子方程式__________________________________________________。
(6)用Al作电极电解NaOH溶液
阳极反应式________________________________________________________;
阴极反应式________________________________________________________;
总反应离子方程式__________________________________________________。
(7)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式________________________________________________________;
阴极反应式_______________________________________________________;
总反应离子方程式___________________________________________________。
(8)用Al单质作阳极,石墨作阴极,电解NaHCO3溶液
阳极反应式__________________________________________________________;
阴极反应式__________________________________________________________;
(9)用惰性电极电解熔融MgCl2
阳极反应式__________________________________________________________;
阴极反应式__________________________________________________________;
总反应离子方程式____________________________________________________。
答案 (1)4OH--4e-===O2↑+2H2O
4Ag++4e-===4Ag
4Ag++2H2O 4Ag+O2↑+4H+
4Ag+O2↑+4H+
(2)2Cl--2e-===Cl2↑
2H++2e-===H2↑
Mg2++2Cl-+2H2O Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
(3)Fe-2e-===Fe2+
2H++2e-===H2↑
Fe+2H2O Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
(4)Fe-2e-+2OH-===Fe(OH)2
2H++2e-===H2↑
Fe+2H2O Fe(OH)2+H2↑
Fe(OH)2+H2↑
(5)Cu-2e-===Cu2+
2H++2e-===H2↑
Cu+2H+ Cu2++H2↑
Cu2++H2↑
(6)2Al-6e-+8OH-===2AlO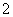 +4H2O 6H2O+6e-===3H2↑+6OH-或6H++6e-===3H2↑
+4H2O 6H2O+6e-===3H2↑+6OH-或6H++6e-===3H2↑
2Al+2H2O+2OH- 2AlO
2AlO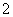 +3H2↑
+3H2↑
(7)2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
2Al+3H2O Al2O3+3H2↑
Al2O3+3H2↑
(8)2Al+6HCO -6e-===2Al(OH)3↓+6CO2↑
-6e-===2Al(OH)3↓+6CO2↑
6H++6e-===3H2↑
(9)2Cl--2e-===Cl2↑
Mg2++2e-===Mg
Mg2++2Cl- Mg+Cl2↑
Mg+Cl2↑


科目:高中化学 来源: 题型:
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A.被氧化的砒霜为1.98 mg
B.分解产生的氢气为0.672 mL
C.和砒霜反应的锌为3.90 mg
D.转移的电子总数为6×10-5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明BF3分子的4个原子在同一平面的理由是( )
A.两个键之间的夹角为120°
B.B—F键为非极性共价键
C.3个B—F键的键能相同
D.3个B—F键的键长相等
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O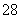 +2I-===2SO
+2I-===2SO +I2 (慢)
+I2 (慢)
I2+2S2O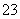 ===2I-+S4O
===2I-+S4O (快)
(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O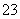 与S2O
与S2O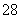 初始的物质的量需满足的关系为n(S2O
初始的物质的量需满足的关系为n(S2O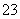 )∶n(S2O
)∶n(S2O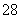 )________________。
)________________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=______________,理由是_______________________________________
________________________________________________________________________。
(3)已知某条件下,浓度c(S2O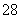 )~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O
)~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O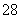 )~t的变化曲线示意图(进行相应的标注)。
)~t的变化曲线示意图(进行相应的标注)。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
【实验Ⅰ】 确定硫的质量:
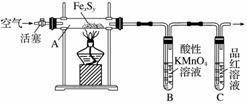
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管 B中加入50 mL 0.100 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后,将B中溶液转移至 250 mL 容量瓶,洗涤试管B后定容。取25.00 mL 该溶液用0.01 mol·L-1的草酸(H2C2O4)溶液滴定剩余的 KMnO4。记录数据如下:
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
相关反应:①2MnO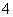 +2H2O+5SO2===2Mn2++5SO
+2H2O+5SO2===2Mn2++5SO +4H+
+4H+
②2MnO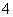 +6H++5H2C2O4===2Mn2++10CO2↑+8H2O
+6H++5H2C2O4===2Mn2++10CO2↑+8H2O
【实验Ⅱ】 确定铁的质量:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。
试回答下列问题:
(1)判断滴定终点的方法是______________________________________________
________________________________________________________________________。
(2)试管C中品红溶液的作用是_____________________________________________。
有同学提出,撤去C装置对实验没有影响,你的看法是________(选填“同意”或“不同意”),理由是___________________________________________________
________________________________________________________________________。
(3)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为________________________________________________________________________。
【问题探究】 滴定过程中,细心的同学发现该KMnO4溶液颜色褪去的速率较平常滴定时要快得多。为研究速率加快的原因,该同学继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
(4)分析上述数据,滴定过程中反应速率加快的一种可能原因是___________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
两个惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解过程中阴极没有H2放出,且电解液在电解前后体积变化可以忽略不计),电极上析出银的质量最大为( )
A.27 mg B.54 mg C.106 mg D.216 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
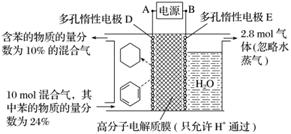
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________________________________________。
③该储氢装置的电流效率η=________。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
A.-488.3 kJ·mol-1 B.+488.3 kJ·mol-1
C.-191 kJ·mol-1 D.+191 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com