
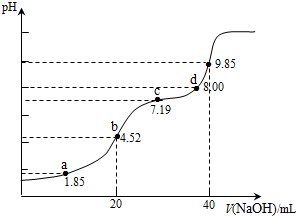
| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c($HS{{{O}_{3}}^{-}}_{\;}$) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
分析 A.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液,a点溶液中溶质为H2SO3和NaHSO3,PH=1.85=Pa1,则c(H2SO3)=c(HSO3-)依据物料守恒判断;
B.b点是用0.1mol•L-1NaOH溶液20ml滴定20mL0.1mol•L-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,依据溶液中电荷守恒和物料守恒计算分析判断;
C.c点PH=7.19=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2O?HSO3-+OH-,Kh=$\frac{c(O{H}^{-})c(HS{{O}_{3}}^{-})}{c(S{{O}_{3}}^{2-})}$=$\frac{Kw}{K{a}_{2}}$,c(OH-)=$\frac{Kw}{c({H}^{+})}$,c(HSO3-)=c(SO32-),结合溶液中物料守恒分析;
D.加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液恰好反应生成Na2SO3,d点溶液中主要是Na2SO3和少量NaHSO3.
解答 解:A.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液,a点溶液中溶质为H2SO3和NaHSO3,PH=1.85=Pa1,电离平衡常数表达式得到则c(H2SO3)=c(HSO3-),溶液体积大于20ml,a点所得溶液中:c(H2SO3)+c(SO32-)+c(HSO3-)=2c(H2SO3)+c(SO32-)<0.1 mol•L-1 ,故A错误;
B.b点是用0.1mol•L-1NaOH溶液20ml滴定20mL0.1mol•L-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),物料守恒c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),得到:c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B正确;
C.c点PH=7.19=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2O?HSO3-+OH-,Kh=$\frac{c(O{H}^{-})c(HS{{O}_{3}}^{-})}{c(S{{O}_{3}}^{2-})}$=$\frac{Kw}{K{a}_{2}}$,c(OH-)=$\frac{Kw}{c({H}^{+})}$,带入计算得到:c(HSO3-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c($HS{{{O}_{3}}^{-}}_{\;}$),故C错误;
D.加入氢氧化钠溶液40ml,NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液恰好反应生成Na2SO3,d点溶液中主要是Na2SO3和少量NaHSO3,溶液中离子浓度c(Na+)>c(SO32-)>c(HSO3-),故D正确;
故选BD.
点评 本题考查了图象变化的分析,酸碱反应溶液酸碱性,盐类水解原理,电解质溶液中离子浓度大小的比较方法等知识,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.01 mol•L-1的醋酸和硫酸溶液中分别加入足量锌片,生成H2的起始速率相等 | |
| B. | 0.1 mol•L-1的NaHCO3溶液中:[Na+]=[HCO3-]+[CO32-]+[H2CO3] | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] | |
| D. | 将0.1 mol的CH3COOH和0.1 mol的CH3COONa溶于水中,配成1L混合溶液.测得溶液的pH<7,则混合液中[CH3COO-]<[Na+] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
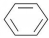 +HNO3(浓)$\frac{\underline{\;\;\;浓硫酸\;\;\;}}{50~60℃}$
+HNO3(浓)$\frac{\underline{\;\;\;浓硫酸\;\;\;}}{50~60℃}$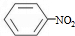 +H2O设计一个实验制取一定量的纯净硝基苯.有关信息见下表:
+H2O设计一个实验制取一定量的纯净硝基苯.有关信息见下表:| 物质 | 熔点/℃ | 沸点/℃ | 相对密度/(20℃) | 毒性 | 水溶性 |
| 苯 | 5.5 | 80.1 | 0.8794 | 有 | 不溶于水 |
| 硝酸 | -41.59 | 83 | 1.503 | - | 易溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 有 | 不溶于水 |
| 硫酸 | 10.0 | 338 | 1.84 | - | 易溶于水 |

| 1 | 用蒸馏水洗涤反应混合液,分液后取下层液体 |
| 2 | |
| 3 | |
| 4 | |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3NA | |
| C. | 0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2L 四氯化碳所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | 由Y与W形成的氧化物溶于水一定是强酸 | |
| B. | Z和Y组成的物质是原子晶体 | |
| C. | Z与Q形成的物质能与H2在一定条件下反应 | |
| D. | X和Y均存在同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com