
工业上合成氨气,已知通入1mol N2和3mol H2,反应过程中共放出a kJ的热量.经测定反应中N2的转化率为20%(已知:N2的转化率=实际反应的N2的量/初始充入N2的总量),则合成氨气的热化学方程式可表示为()
A. N2(g)+3H2(g)⇌2NH3 (g)△H=a kJ/mol
B. N2(g)+3H2(g)⇌2NH3 (g)△H=﹣a kJ/mol
C. N2(g)+3H2(g)⇌2NH3 (g)△H=5a kJ/mol
D. N2(g)+3H2(g)⇌2NH3(g)△H=﹣5a kJ/mol
考点: 热化学方程式.
专题: 化学反应中的能量变化.
分析: 一定条件下,通入1mol N2和3mol H2,反应过程中共放出a kJ的热量.经测定反应中N2的转化率为20%,此时参加反应的氮气的物质的量为0.2mol,并放出akJ热量,则1mol氮气完全参加反应放热5aKJ,依据热化学方程式书写方法标注物质聚集状态和对应反应焓变;
解答: 解:N2(g)+3H2(g)⇌2NH3(g)△H
起始 1mol 3mol
变化 1mol×20% akJ
则1mol氮气完全参加反应放热=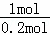 ×aKJ=5aKJ,反应放热△H<0,
×aKJ=5aKJ,反应放热△H<0,
则合成氨气的热化学方程式可表示为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣5a kJ/mol,
故选D.
点评: 本题考查热化学方程式的书写,注意掌握热化学方程式的书写,注意物质聚集状态和对应反应焓变,题目难度不大.


科目:高中化学 来源: 题型:
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是()
A. 次磷酸的电离方程式为H3PO2⇌3H++PO23﹣
B. 次 磷酸中P的化合价为+1
磷酸中P的化合价为+1
C. NaH2PO2是酸式盐
D. NaH2PO2溶液显弱酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛在酸性催化剂存在下三分子聚合可以生成性质相对稳定、毒性小、易于运输的三聚甲醛,反应如图所示.下列说法正确的是()

A. 甲醛水溶液可作为食物防腐剂
B. 该反应类型为缩聚反应
C. 三聚甲醛分子中既含σ键又含п键
D. 常温下,9g三聚甲醛中含1.806×1023个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
2HI(g)⇌H2(g)+I2(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是()

A. 升高温度,反应速率增大,△H减小
B. 升高温度,不影响活化分子百分数
C. 催化剂能降低该反应的活化能
D. 逆反应的活化能等于正反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少了4mol A,乙容器内每分钟减少2mol A,则甲容器内的反应速率比乙容器内的反应速率()
A. 快 B. 慢 C. 相等 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
固体NH4Br置于密闭容器中,某温度下发生反应:NH4Br(s)⇌NH3(g)+HBr(g),2HBr(g)⇌Br2(g)+H2(g),2min后测知H2的浓度为0.5mol•L﹣1,HBr的浓度为4mol•L﹣1,若上述反应速率用v(NH3)表示,则下列速率正确的是()
A. 0.5mol•L﹣1•min﹣1 B. 2.5mol•L﹣1•min﹣1
C. 2mol•L﹣1•min﹣1 D. 1.25mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
能源危机是当前全球问题,开源节流是应对能源危机的重要举措.
(1)下列做法有助于能源“开源节流”的是 (填字母).
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,氧气不足时它们燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示:
(a)通常状况下,金刚石和石墨中 (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为△H= kJ•mol﹣1.
(b)12g石墨在一定量空气中燃烧,生成气体36g,则该过程共放出的热量 kJ.
(3)已知:N2(g)+O2(g)=2NO(g);△H=+180.0kJ•mol﹣1.综合上述有关信息,请写出用CO除去NO的热化学反应方程式
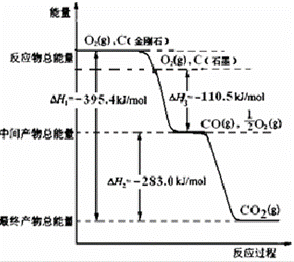
查看答案和解析>>
科目:高中化学 来源: 题型:
已知胆矾溶于水时溶液温 度降低.胆矾分解的热化学方程式为CuSO4•5H2O(s)
度降低.胆矾分解的热化学方程式为CuSO4•5H2O(s) CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1与Q2的关系为()
CuSO4(s)+5H2O(l)△H=+Q1 mol•L﹣1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1与Q2的关系为()
A. Q1>Q2 B. Q1=Q2 C. Q1<Q2 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用化学平衡移动原理解释的是()
A. 合成氨工业中采用高压条件
B. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C. 用排饱和食盐水的方法收集Cl2
D. 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com