
| A. | 用铝块与氧化铁粉末充分混和进行铝热反应 | |
| B. | 取少量蔗糖溶液加稀硫酸水浴加热几分钟后加新制的氢氧化铜浊液加热,观察现象,判断蔗糖水解的产物中是否含有葡萄糖 | |
| C. | 用稀硝酸清洗做过银镜反应实验的试管 | |
| D. | 在苯中加入溴水,充分振荡静置,观察现象,判断苯环中的碳碳键是否存在碳碳双键 |
分析 A.铝块和氧化铁粉末不能充分混合;
B.葡萄糖和新制氢氧化铜悬浊液发生氧化反应需要在碱性条件下;
C.Ag和稀硝酸发生氧化还原反应;
D.苯能萃取溴水中的溴.
解答 解:A.铝块和氧化铁粉末不能充分混合,应该用铝粉和氧化铁粉充分混和进行铝热反应,故A错误;
B.葡萄糖和新制氢氧化铜悬浊液发生氧化反应需要在碱性条件下,在做该实验之前应该先用NaOH溶液中和稀硫酸,否则实验不成功,故B错误;
C.Ag和稀硝酸发生氧化还原反应生成硝酸银、NO和水,所以可以用稀硝酸洗涤做过银镜反应实验的试管,故C正确;
D.振荡后静置观察,溶液分层,上层呈橙红色,下层几乎无色,说明苯环中不含有碳碳双键,若含有碳碳双键则上下两层都会呈无色,故D正确;
故选CD.
点评 本题考查化学实验方案评价,为高考高频点,涉及基本实验操作、物质性质等知识点,明确实验原理是解本题关键,易错选项是B,注意醛发生银镜反应或和新制氢氧化铜悬浊液反应时必须在碱性条件下,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 既是离子键、又有非极性共价键 | |
| B. | 既有极性共价键,又有非极性共价键 | |
| C. | 都是非极性共价 | |
| D. | 都是极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
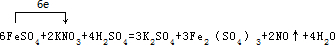 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2L溶液中阴阳离子总数为0.8NA | |
| B. | 500mL溶液中的Ba2+离子浓度为0.2mol•L-1 | |
| C. | 500mL溶液中的NO3-离子总数为0.2NA | |
| D. | 500mL溶液中的NO3-浓度为0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化还原反应前后元素化合价有升降 | |
| B. | 氧化还原反应前后一定有氧的得失 | |
| C. | 氧化还原反应前后一定有电子转移 | |
| D. | 复分解反应和化合反应一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com