
【题目】已知N2O4和NO2可以相互转化:2NO2(g) ![]() N2O4(g) △H<0现将一定量N2O4和NO2的混合气体通入体积为2L的恒温密闭玻璃容器中,发生反应,各物质浓度随时间变化关系如图:
N2O4(g) △H<0现将一定量N2O4和NO2的混合气体通入体积为2L的恒温密闭玻璃容器中,发生反应,各物质浓度随时间变化关系如图:

(1)图中曲线______(填“X”或“Y”)表示c(N2O4)随时间的变化。
(2)从起点开始首次达到平衡时,以NO2表示的反应速率为______。
(3)图中b点的平衡常数K的值为________。
(4)其他条件不变,若起始时向该容器中通入0.4molN2O4和0.2molNO2,则v正_____v逆(填“>”、“=”或“<”);若升温该反应的平衡常数K______(填“增大”、“减小”或“不变”) ,判断理由是_________________。
(5)25min时,改变的外界条件是______,图象中a、b、c、d四点中v正=v逆的点是____,四点中________点体系颜色最深。
【答案】(1)Y;(2)0.04mol/(L·min);(3)1.1;(4)<;减小;N2O4分解NO2是吸热反应,温度升高,平衡左移,平衡常数减小;(5)增大NO2的浓度;bd;c。
【解析】
试题分析:(1)根据反应方程式2NO2(g) ![]() N2O4(g) △H<0可知:在相同时间内NO2、N2O4改变的物质的量的比是2:1,由图像可知Y变化的小于X,实验Y表示的是c(N2O4)随时间的变化;(2)从起点开始首次达到平衡时,反应时间是10min,以NO2表示的反应速率为v(NO2)=(0.6mol/L-0.2mol/L)÷10min=0.04mol/(L·min);(3)图中b点时,c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L。所以此时的平衡常数K=c(N2O4)÷c2(NO2)= 0.4mol/L÷(0.6mol/L)2=0.4÷0.36=1.1;(4)其他条件不变,若起始时向该容器中通入0.4molN2O4和0.2molNO2,c(N2O4)=0.4mol÷2L=0.2mol/L;c(NO2)=0.2mol÷2L=0.1mol/L,Qc= c(N2O4)÷c2(NO2)= 0.2mol/L÷(0.1mol/L)2=0.2÷0.01=20>1.1;则v正<v逆;由于该反应的正反应是放热反应,所以若升温,化学平衡逆向移动,该反应的平衡常数K减小,判断理由是N2O4分解NO2是吸热反应,温度升高,平衡左移,平衡常数减小;(5)根据图像可知,在25min时,c(N2O4)不变,而c(NO2)突然增大,可见改变的外界条件是增大NO2的浓度,图象中a、b、c、d四点中v正=v逆的点是反应处于平衡时的点,是b、d点;反应开始时是反应逆向进行,不断产生NO2,到b点时达到平衡状态,此时c(NO2)比a点大,在c点时增大c(NO2)的浓度,反应正向移动,又使NO2的浓度有所减小,所以四点中c点c(NO2)增大,体系颜色最深。
N2O4(g) △H<0可知:在相同时间内NO2、N2O4改变的物质的量的比是2:1,由图像可知Y变化的小于X,实验Y表示的是c(N2O4)随时间的变化;(2)从起点开始首次达到平衡时,反应时间是10min,以NO2表示的反应速率为v(NO2)=(0.6mol/L-0.2mol/L)÷10min=0.04mol/(L·min);(3)图中b点时,c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L。所以此时的平衡常数K=c(N2O4)÷c2(NO2)= 0.4mol/L÷(0.6mol/L)2=0.4÷0.36=1.1;(4)其他条件不变,若起始时向该容器中通入0.4molN2O4和0.2molNO2,c(N2O4)=0.4mol÷2L=0.2mol/L;c(NO2)=0.2mol÷2L=0.1mol/L,Qc= c(N2O4)÷c2(NO2)= 0.2mol/L÷(0.1mol/L)2=0.2÷0.01=20>1.1;则v正<v逆;由于该反应的正反应是放热反应,所以若升温,化学平衡逆向移动,该反应的平衡常数K减小,判断理由是N2O4分解NO2是吸热反应,温度升高,平衡左移,平衡常数减小;(5)根据图像可知,在25min时,c(N2O4)不变,而c(NO2)突然增大,可见改变的外界条件是增大NO2的浓度,图象中a、b、c、d四点中v正=v逆的点是反应处于平衡时的点,是b、d点;反应开始时是反应逆向进行,不断产生NO2,到b点时达到平衡状态,此时c(NO2)比a点大,在c点时增大c(NO2)的浓度,反应正向移动,又使NO2的浓度有所减小,所以四点中c点c(NO2)增大,体系颜色最深。


科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中正确的是( )
A.正极和负极必须是金属
B.原电池是把化学能转化成电能的装置
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为不同短周期非金属元素的气态单质。在一定条件下能发生反应:Y+X![]() 甲(g) , Y+Z
甲(g) , Y+Z![]() 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
(1)X的结构式是___________。
(2)磷在Z气体中燃烧可生成液态丙(PZ3)分子,也可生成固态丁(PZ5)分子。磷单质和Z单质反应生成lmol丙时,反应过程与能量变化如图I所示,该反应的热化学方程式是____________。已知1mol白磷固体和Z气体反应,生成固态丁时,放热399kJ,则1mol固态丁转化为丙时的反应热△H=_________
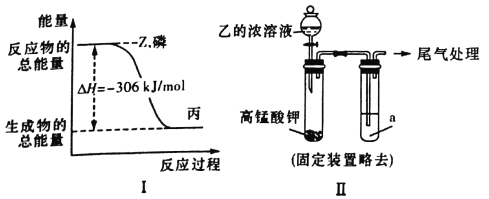
(3)某同学拟用图II所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则a是_______的水溶液。若仅将a换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是____。
(4)向一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若在通入SO2气体的同时加入由X、Y、Z中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SF6是一种优良的绝缘气体,分子结构中只存在S﹣F键.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F﹣F、S﹣F键需吸收的能量分别为160kJ、330kJ.则S(s)+3F2(g)═SF6(g)的反应热△H为( )
A.﹣1780kJ/mol B.﹣1220 kJ/mol C.﹣450 kJ/mol D.+430 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示则
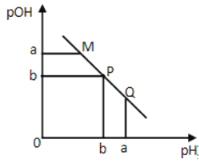
A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池中, B极逐渐变粗,A极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等.实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如图:

(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: .
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是 (部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 .
(4)如何证明洗涤环节充分洗净 .
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 .(用题中所给数据计算并用最简整数比表示结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷分子结构的说法中,错误的是 ( )
A.甲烷分子中含有4个C—H共价健
B.甲烷分子中C—H共价键的夹角为109°28'
C.甲烷是正四面体结构
D.甲烷是一种直线型分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com