
| A. | 4、9、24、14、28 | B. | 1、1、1、1、2 | C. | 8、9、12、10、20 | D. | 任意比均可 |
分析 O2有$\frac{1}{3}$被NO还原,则有$\frac{2}{3}$被NO2还原,根据得失电子守恒,确定NO、NO2+的物质的量,利用N原子、H原子守恒确定H2O、HNO3的物质的量,以此来解答.
解答 解:O2有$\frac{1}{3}$被NO还原,则有$\frac{2}{3}$被NO2还原,根据得失电子守恒,n(O2)×2×$\frac{1}{3}$×(2-0)=n(NO)×(5-2),即n(NO):n(O2)=4:9,
n(O2)×2×$\frac{2}{3}$×(2-0)=n(NO2)×(5-4),即n(NO2):n(O2)=8:3,
设氧气的物质的量为x,即n(NO)=$\frac{4}{9}$x,n(NO2)=$\frac{8}{3}$x,
由N原子守恒,可知生成HNO3 $\frac{28x}{3}$mol,
由H原子守恒,可知H2O为$\frac{14}{9}$xmol,
所以NO、O2、NO2、H2O、HNO3的物质的量之比=$\frac{4}{9}$x:x:$\frac{8}{3}$x:$\frac{28x}{3}$mol=4:9:24:14:28,该反应方程式为:4NO+9O2+24NO2+14H2O═28HNO3,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握氧化还原反应中电子守恒及原子守恒为解答的关键,侧重分析能力及计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol H2S可还原4mol的KIO3 | |
| B. | 氧化剂和还原剂物质的量之比为5:4 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用少量水稀释0.1mol•L-1氨水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 将Na2CO3溶液从20℃升温至30℃,溶液中增大$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}$增大 | |
| C. | 向NH4Cl溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3•H2O) | |
| D. | pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
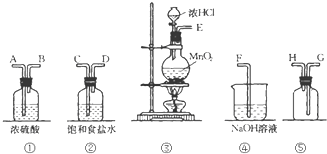 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
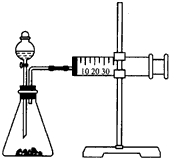 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
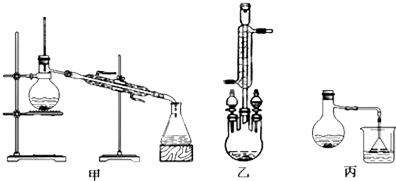
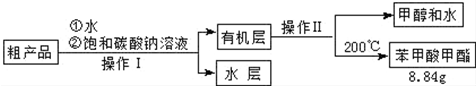
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com