
 三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3?6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3?6H2O晶体.
三氯化铁是中学化学实验室中必不可少的重要试剂.某兴趣小组利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3?6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3?6H2O晶体.| 56V |
| 22.4 |
| ||
| m |
| 56V |
| 22.4m |
 ,
,| 56V |
| 22.4m |
 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )
如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )| A、锌做负极发生氧化反应 |
| B、供电时的总反应为:Zn+2H+=Zn2++H2 |
| C、该装置可实现化学能转化为电能 |
| D、产生1molH2,消耗锌的质量32.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
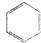 看,分子中含有碳碳双键,由此推测,苯能使酸性高锰酸钾溶液褪色且苯的6个碳原子之间的键有两种.
看,分子中含有碳碳双键,由此推测,苯能使酸性高锰酸钾溶液褪色且苯的6个碳原子之间的键有两种.查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g).
Ⅰ、碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g).查看答案和解析>>
科目:高中化学 来源: 题型:
 ,俗名为水杨酸,在 医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:
,俗名为水杨酸,在 医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com