
| A. | 0.1mol Fe和0.1mol Zn被氧化,共转移电子0.2mol | |
| B. | 标准状况下,22.4L N2和N2O4的混合物,含N原子2mol | |
| C. | 16g O2和O3的混合物,含电子8mol | |
| D. | 常温常压下,12g CO和12g N2体积相等 |
分析 A.0.1molFe被氧化可能失去0.2mol或0.3mol电子,0.1molZn失去0.2mol电子;
B.标准状况下,气体摩尔体积为22.4L/mol,结合N2和N2O4分子中都含有2个N原子分析;
C.16g O2和O3的混合物中含有16gO,根据n=$\frac{m}{M}$计算出含有氧原子的物质的量,结合氧原子含有8个电子计算;
D.CO和12g N2的摩尔质量都是28g/mol,相同条件下气体摩尔体积相同.
解答 解:A.由于Fe反应后可能变成亚铁离子或铁离子,无法计算0.1molFe被氧化失去电子的物质的量,则无法计算总共转移电子的物质的量,故A错误;
B.标准状况下22.4LN2和N2O4的混合物的物质的量为1mol,1molN2和N2O4的混合物中含有2molN原子,故B正确;
C.16g O2和O3的混合物中含有氧原子的质量为16g,含有氧原子的物质的量为:$\frac{16g}{16g/mol}$=1吗ol,1molO中含8mol电子,故C正确;
D.12g CO和12g N2的物质的量都为:$\frac{12g}{28g/mol}$=$\frac{3}{7}$mol,同温同压下气体摩尔体积相同,根据V=nVm可知,二者具有体积相等,故D正确;
故选A.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积之间的关系为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
 元素在周期表中的位置,反映了元素的原子结构和元素性质.图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素性质.图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
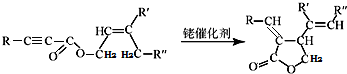
 ,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
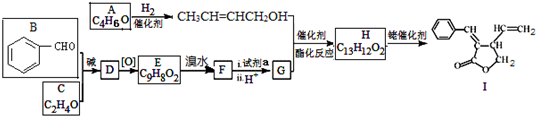
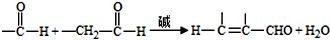
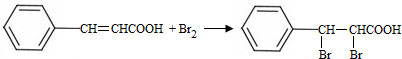 ;试剂a 是NaOH、醇溶液.
;试剂a 是NaOH、醇溶液.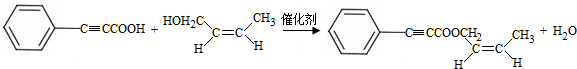 .
.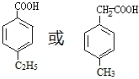 (写出一种即可).
(写出一种即可). 和CH3CHO为原料合成
和CH3CHO为原料合成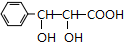 的合成路线流程图:
的合成路线流程图: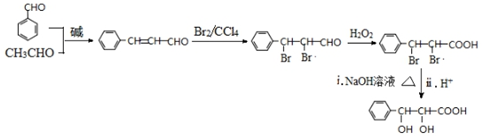 .(其它试剂任选,合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
.(其它试剂任选,合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | ↓ | ↓↑ | ↓ | ↓ | ↑ |
| A. | AlCl3、HCl、AgNO3、Na2CO3 | B. | AgNO3、HCl、Na2CO3、AlCl3 | ||
| C. | Na2CO3、AlCl3、HCl、AgNO3 | D. | AgNO3、HCl、AlCl3、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com