
有一同学向盛有品红溶液的试管中通入一种气体后,品红溶液褪色。请设计简单实验证明该同学通入的气体是Cl2还是SO2。
科目:高中化学 来源: 题型:
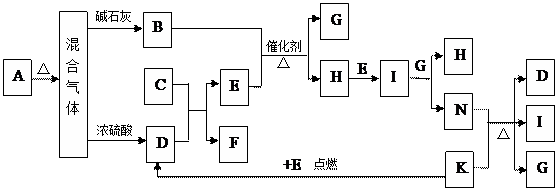
下图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质。固态物质A加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示:
 请回答下列问题:
请回答下列问题:
(1)写出实验室检验A物质中含有的阳离子的方法 。
(2)B与E反应得到1molH,则此时转移电子的物质的量为 mol。
(3)写出实验室制取B的化学方程式 。
(4)写出N的稀溶液与过量的铁粉反应的离子方程式 。
(5)此固体A可能为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是 ( )
A. Cu(OH)2+HCl;Cu(OH)2+CH3COOH B. NaHCO3+H2SO4;KHCO3+HCl
C. NaHCO3+NaOH;Ca(HCO3)2+NaOH D. BaCl2+H2SO4;Ba(OH)2+H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于环境问题的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中的SO2
B.臭氧的体积分数超过10-5%的空气有利于人体的健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水污染
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2既有氧化性,又有还原性,主要表现为还原性。下列反应中,SO2表现为氧化性的反应是( )
A、SO2+2H2S=3S↓+2H2O B、SO2+NO2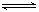 SO3+NO
SO3+NO
C、SO2+2KOH=K2SO3+H2O D、SO2+2H2O+Cl2=H2SO4+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Cl2和SO2性质的叙述正确的是( )。
A.相同条件下,Cl2比SO2更易溶于水
B.在一定条件下,SO2比Cl2更易液化
C.常温下,等体积的Cl2和SO2混合气体通入BaCl2溶液时,无明显现象
D.等体积的Cl2和SO2分别通入含石蕊的水中,溶液的紫色立即褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
| A | B | C | D |
|
|
|
|
|
| 升高温度,平衡常数减小 | 0~3s内,反应速率为 |
| 达到平衡时,仅改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟有左下图所示的装置模拟制取并收集ClO2。
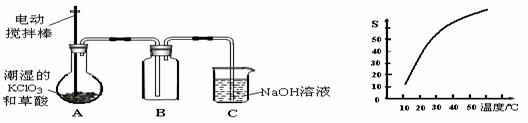
(1)B必须放在冰水浴中控制温度,其原因是 ;
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
① ;② ;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知2 Na2S2O3 + I2 →Na2S4O6 + 2NaI)
①配制70 mL c mol/LNa2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②步骤2中发生反应的离子方程式为: 。
③判断滴定终点的现象 。
原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 ;若滴定开始仰视读数,滴定终点时正确读数,则测定结果 。(填 “偏高”“偏低”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com