
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
【答案】(1)1s22s22p63s1或[Ne]3s1;Cl
(2)H2S分子间不存在氢键,H2O分子间存在氢键
(3)平面三角形
(4)Na+
(5)K2Cr2O7+3H2O2+ 4H2SO4===K2SO4+Cr2(SO4)3+3O2↑+7H2O
【解析】试题分析:M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,核外电子排布式为1s22s22p4,故M为O元素;由原子序数可知R、X、Y均处于第三周期,R是同周期元素中最活泼的金属元素,则R为Na;X和M形成的一种化合物是引起酸雨的主要大气污染物,则X为S元素,可知Y为Cl;Z的基态原子4s和3d轨道半充满,外围电子排布式为3d54s1,处于VIB族,故Z为Cr。
(1)R为Na,基态原子的电子排布式是1s22s22p63s1,同周期自左而右电负性增大,故Cl元素电负性大于S的。
故答案为:1s22s22p63s1;Cl;
(2)H2O分子能形成氢键,使水的沸点升高,而H2S不能形成氢键,故硫化氢的沸点低于水的。
故答案为:H2O分子能形成氢键,而H2S不能形成氢键;
(3)X与M形成的SO3分子中S原子孤电子对数=![]() =0,价层电子对数为3+0=3,故其空间构型为平面三角形。
=0,价层电子对数为3+0=3,故其空间构型为平面三角形。
故答案为:平面三角形;
(4)M和R所形成的一种离子化合物为Na2O,晶胞中黑色球数目为8,白色球数目为8×1/8+6×1/2=4,黑色球与白色球数目之比为2:1,故图中黑球代表的离子是Na+。
故答案为:Na+;
(5)Z的最高价含氧酸的钾盐(橙色)为K2Cr2O7,与氧元素的氢化物发生氧化还原反应,该氢化物为H2O2,在稀硫酸中,Cr元素被还原为+3价,H2O2被氧化生成氧气,反应方程式为:3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2↑+7H2O+K2SO4。
故答案为:3H2O2+K2Cr2O7+4H2SO4=Cr2(SO4)3+3O2↑+7H2O+K2SO4


科目:高中化学 来源: 题型:
【题目】0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。

请回答下列问题:
(1)试确定200℃时固体物质的化学式________(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为____________,其存在的最高温度是________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为________;
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________mol·L-1(Ksp=2.2×10-20)。若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.丙烯酸和油酸互为同系物
B.淀粉和纤维素互为同分异构体
C.CuSO4浓溶液能使蛋白质溶液发生盐析
D.麦芽糖和脂肪在一定条件下都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题。
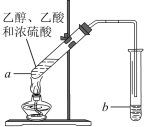
(1)乙醇分子中官能团的名称是__________________。
(2)试管a中加入几块碎瓷片的目的是____________。
(3)试管a中加入浓硫酸的作用: 。
(4)试管a中发生反应的化学方程式为_____________________________________________。
(5)反应开始前,试管b中盛放的是____________溶液。
(6)可用____________方法把制得的乙酸乙酯分离出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是( )
A.范德华力、范德华力、范德华力
B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下食品中的有机成分属于高分子化合物的是
A. 谷类中含有的淀粉 B. 植物油、动物脂肪中含有的油脂
C. 食醋中含有的醋酸 D. 酒中含有的酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年6月25日20时00分,我国新一代运载火箭“长征七号”在海南文昌航天发射场点火升空,首飞成功。“长征七号”运载火箭使用的是液氧煤油推进剂,下列说法不正确的是
A.工业上可利用空气冷冻成液体后再分离来获得液氧
B.煤油燃烧后的主要产物是水和二氧化碳,绿色环保
C.煤油属于纯净物.主要成分是烃
D.火箭装载的燃料越多,说明其动力越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究溴乙烷的消去反应并验证产物。
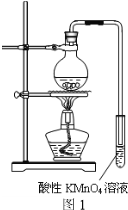
实验过程:组装如图1所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)请写出溴乙烷的消去反应的化学方程式:
(2)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(3)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法: 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(4)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是 ,此时发生反应的化学方程式为 。
(5)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
① ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.化学反应只生成新物质,没有能量的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com