
| A. | 常温常压下,71g氯气与足量金属钠充分反应,转移的电子数为2 NA | |
| B. | 1.8g的NH4+离子中含有的电子数NA | |
| C. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA | |
| D. | 1 mol/L MgSO4溶液中所含SO42-数目为NA |
分析 A、求出氯气的物质的量,然后根据氯气和钠反应后变为-1价来分析;
B、求出铵根离子的物质的量,然后根据铵根离子中含10个电子来分析;
C、NO2和N2O4均由NO2构成;
D、溶液体积不明确.
解答 解:A、71g氯气的物质的量为1mol,而氯气和钠反应后变为-1价,故1mol氯气转移2mol电子即2NA个,故A正确;
B、1.8g铵根离子的物质的量为0.1mol,而铵根离子中含10个电子,故0.1mol铵根离子中含NA个电子,故B正确;
C、NO2和N2O4均由NO2构成,故46gNO2和N2O4混合物中含有的NO2的物质的量为1mol,故含3mol原子即3NA个,故C正确;
D、溶液体积不明确,故溶液中的硫酸根的个数无法计算,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、苯和溴苯 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、已烯、己烷 | |
| C. | 用饱和碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用燃烧法鉴别乙醇、苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X、Y、Z三种元素的原子半径,Z的原子半径最小 | |
| B. | X和Y的单质(已除去表面氧化膜且形状完全一样)分别与等浓度的稀硫酸反应时,前者反应明显比后者剧烈 | |
| C. | 同分异构现象的广泛存在是含N的化合物种类繁多的原因之一 | |
| D. | M的氢化物的酸性比Z的氢化物强,因此M的气态氢化物比较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的反应速率和SO3的生成速率相等 | |
| B. | SO2的物质的量等于SO3的物质的量 | |
| C. | SO2的物质的量不再变化 | |
| D. | SO2的百分含量是O2百分含量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数(25℃) |
| 碳酸 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| 次溴酸 | Ka=2.4×10-9 |
| A. | HBrO+Na2CO3═NaBrO+NaHCO3 | B. | 2HBrO+Na2CO3═2NaBrO+H2O+CO2↑ | ||
| C. | HBrO+NaHCO3═NaBrO+H2O+CO2↑ | D. | NaBrO+NaHCO3═Na2CO3+HBrO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
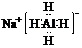 ,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子的电子式:Na+ | B. | 碳-12原子:${\;}_{12}^{6}$C | ||
| C. | 氯化钙电子式: | D. | OH-的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件和部分副产 物未标出),其中反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件和部分副产 物未标出),其中反应①是置换反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用白糖的主要成分是蔗糖 | B. | 纤维素不能水解成葡萄糖 | ||
| C. | 蛋白质水解的最终产物是多肽 | D. | 植物油的主要成分是高级脂肪酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com