
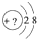 某同学在画某种元素的一种单核微粒的结构的示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构的示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断. .
. 分析 (1)该微粒是中性微粒,质子数10,为Ne原子;
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,则原子质子数为2+8-1=9,为F-离子,其单质氟气与水反应生成HF与氧气;
(3)该微粒的还原性很弱,失去2个电子后变成原子,据此可知该原子的核外有8个电子;
(4)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,则原子质子数为2+8+1=11,为Na+离子,其单质Na与水反应生成氢氧化钠与氢气;
(5)该微粒的符号为X3-,则该微粒所对应的原子的核外有7个电子,即氮原子,则对应的单质为氮气,分析其电子式.
解答 解:(1)该微粒是中性微粒,则为Ne原子,故答案为:Ne;
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,则原子质子数为2+8-1=9,为F-离子,其单质氟气与水反应生成HF与氧气,反应方程式为:2F2+2H2O=4HF+O2,故答案为:2F2+2H2O═4HF+O2;
(3)该微粒的还原性很弱,失去2个电子后变成原子,据此可知该原子的核外有8个电子,即为氧原子,则在周期表中的位置为第二周期第VIA族,故答案为:第二周期第VIA族;
(4)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,则原子质子数为2+8+1=11,为Na+离子,其单质Na与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(5)该微粒的符号为X3-,则该微粒所对应的原子的核外有7个电子,即氮原子,则对应的单质为氮气,氮气的电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查较为综合,为高频考点,涉及结构示意图、结构式、离子方程式等,要注意阴离子:质子数=核外电子数-电荷数,阳离子=核外电子数+电荷数,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 第一列的元素都是金属元素 | |
| B. | 第三列所含的元素种类最多 | |
| C. | 第18列元素原子的最外层电子数均为8 | |
| D. | 只有第二列元素的最外层电子数为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常情况下,甲烷和强酸、强碱、强氧化剂不起反应 | |
| B. | 光照下甲烷与氯气发生取代反应 | |
| C. | 甲烷的氯代物CHCl3、CCl4都难溶于水 | |
| D. | 甲烷在光照条件下与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:1 | B. | 2:1 | C. | 1:4 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同一个电子层上运动的电子,其自旋方向肯定不同 | |
| B. | 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 | |
| C. | 物质的键能越大,该物质本身具有的能量越低 | |
| D. | 在周期表中原子的族序数等于它的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12种 | B. | 13种 | C. | 14种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| V(M)(x10-3mol.L-1.min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com