
| 实验操作、现象 | 实验结论 | |
| A | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置后CCl4层均有颜色 | 氧化性:Fe3+>Br2>I2 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量SO42- |
| C | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| D | 除锈的铁钉在浓硝酸中浸泡后,用蒸馏水洗净,再放入CuSO4溶液中无现象 | 铁钉表面形成了一层致密稳定的氧化膜 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铁离子的氧化性小于溴单质,将FeCl3溶液分别滴入NaBr后不发生反应;
B.该沉淀可能为氯化银,原溶液中不一定含有硫酸根离子;
C.二者发生了氧化还原反应,二氧化硫表现了还原性;
D.铁与浓硫酸、浓硝酸发生钝化现象、.
解答 解:A.将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡后盛有碘化钠的溶液的有机层有色,而盛有溴化钠的溶液的有机层呈无色,故A错误;
B.向某溶液中加入盐酸酸化的氯化钡溶液,出现白色沉淀,该沉淀可能为AgCl,原溶液中不一定含有硫酸根离子,故B错误;
C.将SO2通入溴水中,溴水褪色,二者发生了氧化还原反应,二氧化硫表现了还原性,不是漂白性,故C错误;
D.除锈的铁钉在浓硝酸中浸泡后发生钝化现象,即铁钉表面形成了一层致密稳定的氧化膜,阻止了反应的继续进行,则再放入CuSO4溶液中无现象,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及氧化还原反应、离子检验、二氧化硫性质及钝化现象等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 150mL2mol•L-1的KCl溶液 | B. | 75mL4mol•L-1的NH4Cl溶液 | ||
| C. | 75mL1.5mol•L-1MgCl2溶液 | D. | 150mL1mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液可能由等物质的量浓度等体积的 NaOH 溶液和 CH3COOH 溶液混合而成 | |
| B. | 该溶液可能由 pH=3 的 CH3COOH 与 pH=11 的 NaOH 溶液等体积混合而成 | |
| C. | 加入适量 NaOH,溶液中离子浓度为 c(CH3COO- )>c(Na+)>c(OH-)>c(H+) | |
| D. | 加入适量氨水,c(CH3COO-)一定大于 c(Na+)、c(NH4+)之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度相同、体积相同的 O2(g)和 N2(g)分子数相同 | |
| B. | 等温等压下,SO2气体与 CO2气体的密度之比等于 16:11 | |
| C. | 温度和容积相同的两气罐中分别盛有 5 mol O2(g)和 2 molN2 (g),两容积中的压强之比等于 5:2 | |
| D. | 等温等压条件下,5 molO2(g)和 2 molH2(g)的体积之比等于 5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子式 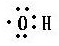 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 比例模型  可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 结构示意图为  的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| D. | 原子结构示意图 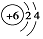 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
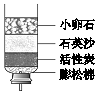
| A. | 净水过程中发生了化学变化 | B. | 该净水器能杀菌消毒 | ||
| C. | 活性炭的主要作用是吸附杂质 | D. | 净化后的水属于纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质焰色反应呈黄色,说明该物质一定是钠盐 | |
| B. | 某溶液加NaOH溶液生成蓝色沉淀,说明该溶液中一定含有Mg2+ | |
| C. | 某无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,说明该溶液中一定含有SO42- | |
| D. | 某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明该溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com