
| A. | 金属性保持不变 | B. | 非金属性逐渐增强 | ||
| C. | 金属性逐渐增强 | D. | 非金属性保持不变 |
科目:高中化学 来源: 题型:选择题
| A. | 烟、云、雾不属于胶体分散系 | |
| B. | 胶体和溶液可以用萃取的方法进行分离 | |
| C. | 用过滤的方法可以将NaCl从Fe(OH)3胶体和NaCl混和物中分离出来 | |
| D. | 用丁达尔效应可以区分胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和
 和
和
 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H原子中的中子和质子 | |
| B. | Be2+离子中的质子和电子 | |
| C. | NaHCO3晶体中的阳离子和阴离子 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液和稀盐酸反应:H++OH-═H2O | |
| B. | 大理石与盐酸反应制取二氧化碳:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁粉投入FeCl3溶液中:Fe+Fe3+═2Fe2+ | |
| D. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
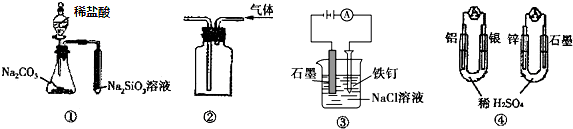
| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集CH4气体 | |
| C. | 装置③可电解食盐水制氯气 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com