
【题目】氧化还原反应在生产和生活中使用非常广泛.
(1)I、NaNO2外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:
2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
上述反应中氧化剂是 .
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①碘化钾淀粉试纸 ②淀粉 ③白酒 ④食醋,你认为应选用的物质有(填序号).
(3)某厂废液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 .
A.NaCl
B.NH4Cl
C.HNO3
D.浓H2SO4
(4)II.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.根据下列反应回答问题:
A.Na2O2+2HCl═2NaCl+H2O2
B.Ag2O+H2O2═2Ag+O2↑+H2O
C.2H2O2═2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O
上述反应中,H2O2仅体现氧化性的反应是(填序号,下同) , H2O2既体现氧化性又体现还原性的反应是 .
(5)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是
(6)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO4﹣、H2O、Mn2+、H2O2、H+ . 已知该反应中H2O2只发生了如下过程:H2O2→O2 .
①将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中□+□
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为mol.
(7)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为 .
【答案】
(1)NaNO2
(2)①④
(3)B
(4)D,C
(5)Ag2O>H2O2>K2CrO4
(6)0.6
(7)KHCO3
【解析】解:I、(1)2NaNO2+4HI═2NO+I2+2NaI+2H2O,氮元素的化合价降低,所以NaNO2是氧化剂,
所以答案是:NaNO2;
(2)淀粉、白酒与NaNO2都不反应,所以无明显现象;KI与NaNO2反应生成I2必须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,
所以答案是:①④;
(3)NaNO2→N2是被还原,必须加还原剂;N元素氧化性弱于O和Cl元素,故只能加NH4Cl作还原剂.方程式为NaNO2+NH4Cl═NaCl+N2↑+2H2O,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,
所以答案是:B;
II.(4)D中双氧水中氧元素化合价降低,说明双氧水作氧化剂,体现了氧化性,C中双氧水中氧元素化合价升高,体现还原性,
所以答案是:D;C;
(5)反应Ag2O+H2O2=2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2,反应3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中,双氧水做氧化剂,铬酸钾做氧化产物,则氧化性H2O2>K2CrO4,故氧化性顺序为:Ag2O>H2O2>K2CrO4,
所以答案是:Ag2O>H2O2>K2CrO4;
(6)①该反应过程中,高锰酸根的氧化性和双氧水的还原性导致二者间发生氧化还原反应,高锰酸根离子中锰元素从+7变为+2价,化合价降低5价,双氧水中氧元素化合价从﹣1价变为0价,化合价至少升高2价,则高锰酸根离子的系数为2,双氧水的系数为5,然后利用质量守恒配平可得该反应的离子方程式为:2MnO4﹣+5H2O2+6H+=2Mn2++8H2O+5O2↑,
所以答案是:2MnO4﹣+5H2O2+6H+=2Mn2++8H2O+5O2↑;
②上述反应中生成5mol氧气转移电子10mol,当反应中有6.72L(标准状况)即0.3mol氧气生成时,则转移的电子为:10mol× ![]() =0.6mol,
=0.6mol,
所以答案是:0.6;
(7)反应KCN+H2O2+H2O═A+NH3↑中,根据原子守恒可知生成物A的化学式为KHCO3;
所以答案是:KHCO3.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】1 L水中溶有Mg(HCO3)2和CaCl2的浓度分别是bmol/L和2bmol/L,现用一种试剂(适量)把Ca2+、Mg2+除去,这种试剂最好选用( )
A.Ca(OH)2B.NaOH
C.NaHCO3D.Na2CO3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子晶体:
①HCl ②HBr ③HI ④CO ⑤N2 ⑥H2
熔、沸点由高到低的顺序是( )
A.①②③④⑤⑥
B.③②①⑤④⑥
C.③②①④⑤⑥
D.⑥⑤④③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)2C(气)△H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
X | Y | |
A | 减小压强 | A的转化率 |
B | 升高温度 | 混合气体平均分子量 |
C | 升高温度 | A的浓度 |
D | 增加压强 | B的转化率 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式C(s)+H2O(g) ![]() CO(g)+H2(g);△H=+131.3kJ/mol表示( )
CO(g)+H2(g);△H=+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 I1 I2 I3 I4 … |
In/kJ.mol﹣1 578 1817 2745 11578 … |
则该元素是(填写元素符号).
(2)基态锗(Ge)原子的电子排布式是 . Ge的最高价氯化物分子式是 . 该元素可能的性质或应用有 .
A.是一种活泼的金属元素 B.其电负性大于硫 C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物 ![]() , 下列叙述正确的有 .
, 下列叙述正确的有 .
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2﹣丁烯
(4)NaF的熔点  的熔点(填>、=或<),其原因是 .
的熔点(填>、=或<),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题: 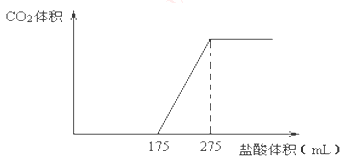
(1)加入盐酸后总共产生的气体在标准状况下的体积为L;
(2)盐酸中HCl的物质的量浓度;
(3)反应后的固体的成分(填化学式);
(4)x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是
选项 | 物质 | 选用的试剂 | 操作方法 |
A | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
B | CO2(CO) | 氧气 | 点燃 |
C | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
D | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com