

| A. | 互为同系物 | B. | 均可发生硝化反应 | ||
| C. | 均可与碳酸氢钠反应 | D. | 均最多有7个碳原子共平面 |
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶液加热 | B. | CH3COONa溶液加热 | ||
| C. | 氨水中加入少量NH4Cl | D. | Na2CO3溶液中加入BaCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2S | C. | Ba(OH)2 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| B. | 原子半径由小到大的顺序为:X<Z<Y<W | |
| C. | 与同浓度的盐酸反应,Z比W更剧烈 | |
| D. | X的氧化物是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
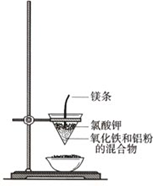 铁和铝是两种重要的金属.请回答:
铁和铝是两种重要的金属.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
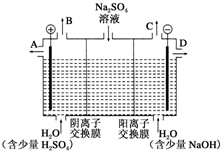 芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com