
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
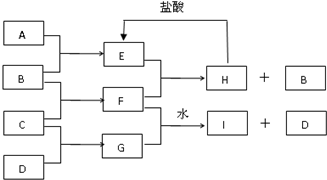 A、B、C、D是按原子序数由小到大排列的第二、第三周期元素的单质.B、E均为组成空气的成分.D为淡黄色固体.F的焰色反应呈黄色.一定条件下,各物质之间的相互关系如图所示(图中部分产物没有列出).
A、B、C、D是按原子序数由小到大排列的第二、第三周期元素的单质.B、E均为组成空气的成分.D为淡黄色固体.F的焰色反应呈黄色.一定条件下,各物质之间的相互关系如图所示(图中部分产物没有列出).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 第4周期 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 高温 |

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该硫酸的物质的量浓度为9.2mol?L |
| B、1mol Zn与足量的该硫酸反应产生2g氢气 |
| C、配制200mL 4.6mol?L的稀硫酸需取该硫酸50mL |
| D、50mL该硫酸溶液中加入足量的铜片并加热,充分反应后被还原的硫酸的物质的量为0.46mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com