
| A. | 该溶液中H+、NH4+、NO3-、Cl-可以大量共存 | |
| B. | Cu(NH3)4SO4中呈正四面体的原子团只有SO42- | |
| C. | 滴加Na2CO3溶液产生CuCO3蓝色沉淀 | |
| D. | 硫酸铜溶液与氨水作用后可缓缓加入乙醇可产生晶体,其产生晶体的主要原理是CuSO4+4NH3═[Cu(NH3)4]SO4 |
分析 硫酸铜和氨水反应生成氢氧化铜沉淀,当氨水过量时,氨水和氢氧化铜反应生成硫酸四氨合铜溶液,硫酸四氨合铜化学式为[Cu(NH3)4]SO4,电离方程式为:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-,缓缓加入乙醇可产生晶体,为一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4SO4)•H2O蓝色正交晶体,反应方程式为CuSO4+4NH3+H2O=[Cu(NH3)4]SO4•H2O.
A.硫酸根离子和铜氨络离子之间存在离子键、Cu原子和N原子之间存在配位键,该溶液中H+与NH3与结合成稳定的NH4+,不能大量共存;
B.根据价层电子对互斥理论确定微粒的空间构型,价层电子对个数=σ键个数+孤电子对个数,Cu(NH3)4SO4中呈正四面体的原子团只有SO42-;
C.碳酸钠和硫酸铜之间发生双水解反应;
D.硫酸铜溶液与氨水作用后可缓缓加入乙醇可产生晶体,为一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4SO4)•H2O蓝色正交晶体.
解答 解:A.硫酸四氨合铜化学式为[Cu(NH3)4]SO4,电离方程式为:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-,氨气虽为內界离子,但NH3能提供孤对电子,H+能与NH3与结合成稳定的NH4+,所以该溶液中若有H+,能破坏硫酸四氨合铜配合物晶体中Cu2+与NH3之间的配位键,不能大量共存,故A错误;
B.[Cu(NH3)4]SO4中,氨气中价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4且含有1个孤电子对,所以N原子采用sp3杂化,其空间构型为三角锥形结构;S与4个O形成共价键,则含有4个σ键,孤电子对数=$\frac{6+2-2×4}{2}$=0,应为sp3杂化,为正四面体结构,则呈正四面体结构的原子团是SO42-,故B正确;
C.滴加Na2CO3溶液,铜离子和碳酸根离子两者相互促进水解反应,生成Cu(OH)2蓝色沉淀,原理为:Na2CO3+CuSO4+H2O=Cu(OH)2↓+Na2SO4+CO2↑,故C错误;
D.乙醇分子极性弱于水的极性,晶体在乙醇中溶解度降低,硫酸铜溶液与氨水作用后可缓缓加入乙醇可产生晶体,为一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4SO4)•H2O蓝色正交晶体,反应方程式为CuSO4+4NH3+H2O=[Cu(NH3)4]SO4•H2O,故D错误;
故选B.
点评 本题考查配合物的有关知识,明确配位键的结构、性质等,明确利用价层电子对互斥理论确定微粒空间构型以及配位键的性质是解答关键,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在滴加酸碱指示剂酚酞试液后呈现红色的溶液中:Na+、Cl-、AlO2-、CO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液中:HCO3-、Al3+、NH4+、ClO- | |
| C. | 在$\frac{c({H}^{+})}{c(0{H}^{-})}$=1×1012的溶液中:Fe2+、Mg2+、CO32-、NO3- | |
| D. | 在AlCl3溶液中:K+、NO3-、S2-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH变小 | B. | 阴极逸出气体 | ||
| C. | 阳极附近溶液呈蓝色 | D. | 阴极附远溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入NaHCO3溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入AlCl3溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中只存在H+,不存在0H-,只有中性溶液或纯水中既有H+又有OH- | |
| B. | 温度越高,KW越大,所以温度高的溶液中的c(H+)一定比温度低的溶液中的c(H+)大 | |
| C. | 水的电离平衡受酸、碱和温度等条件的影响 | |
| D. | 向水中加人碱时,由于加人的OH-与水电离产生的H+作用.使c(H+)减小,平衡向电离的方向移动. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1s22s22p3 | B. | 1s22s22p63s23p63d34s2 | ||
| C. | 1s22s22p63s23p6 | D. | 1s22s22p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
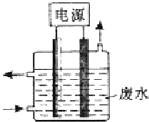 用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极附近碱性增强,阳极附近碱性减弱 | |
| D. | 除去CN-的反应:5ClO-+2CN-+2H+═N2↑+2CO2↑+5Cl-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com