
分析 根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
(1)高锰酸钾具有强氧化性,能腐蚀橡皮管;
(2)取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,发生的反应是草酸根离子被高锰酸根离子酸性溶液中发生氧化还原反应生成二氧化碳、锰离子和水,铁离子和锌反应生成亚铁离子和锌离子;
(3)根据滴定原理以及高猛酸根离子的颜色来确定滴定终点;
(4)若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高;若滴定前仰视读数,滴定后俯视读数读取的标准溶液体积偏小,结合c(待测)=$\frac{c(标准)c(标准)}{c(待测)}$分析判断;
(5)根据离子方程式计算,n(Fe)=5n(MnO4-),可以计算m(Fe),然后可以计算晶体中铁的质量分数;
解答 解:(1)高锰酸钾具有强氧化性,能腐蚀橡皮管,所以用酸式滴定管盛放,
故答案为:酸式;
(2)取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+,结合原子守恒和电荷守恒写出反应的离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,
(3)当滴入最后一滴KMnO4溶液,溶液无色变为紫红色且半分钟不褪色,则达到了滴定终点,
故答案为:当最后一滴高锰酸钾加入后,溶液颜色变为紫红(浅红色)色,且半分钟内不褪色;
(4)若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,在步骤三中,若滴定前仰视读数,滴定后俯视读数,读取标准溶液的体积减小,则测得的铁含量偏低,
故答案为:偏高;偏低;
(5)根据离子方程式计算,5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
n(Fe)=5n(MnO4-)=5×$\frac{20.02+19.98}{2}$×0.01×10-3×10=1.0×10-2mol,
m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.
晶体中铁的质量分数=$\frac{0.56g}{5g}$×100%=11.2%,
故答案为:11.2%;
点评 本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题,题目难度中等.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 14N和14C属于不同核素,它们互为同位素 | |
| B. | 1H和2H是同种元素,它们核外电子数不相等 | |
| C. | 14C和14N的质量数相等,中子数也相等 | |
| D. | 6Li和7Li的质子数相等,二者互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 用惰性电极电解CuSO4溶液:2Cu2++2H2O═4H++O2↑+2Cu | |
| D. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳、氮氧化物是酸雨形成的主要因素 | |
| B. | 汽车尾气可通过净化装置将碳氢化合物还原成CO2和H2O | |
| C. | 含铅化合物导致人体蛋白质变性是物理变化 | |
| D. | 固体悬浮微粒是造成雾霾天气的一种重要因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
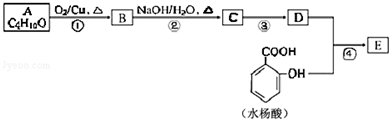
 ;
;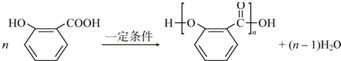 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
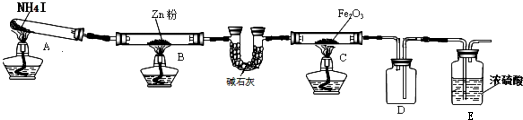
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 青蒿素属于无机化合物 | |
| B. | 青蒿素属于氧化物 | |
| C. | 标准状况下,1mol青蒿素的体积约为22.4L | |
| D. | 青蒿素的摩尔质量为282g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.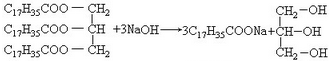 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com