
化学基本概念、化学用语是中学化学学习的重要内容之一。
I:氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应过程的离子方程式为:N +4H++3e-
+4H++3e- NO+2H2O。
NO+2H2O。
下列四种物质:KMnO4,Na2CO3,Na2SO3,Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生。
(1)被还原的元素是___________;还原剂是_________。
(2)写出并配平该氧化还原反应的离子方程式:_________________。
(3)若反应后,还原产物的化合价降低,而其他物质价态保持不变,则反应中氧化剂与还原剂的物质的量之比将_______(填“增大”“不变”减小”或“不能确定”)。
II:实验室需要用Na2CO3 l0H2O配制0.10mol/L Na2CO3溶液240mL。
l0H2O配制0.10mol/L Na2CO3溶液240mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、__________、___________。
(2)计算。
(3)称量。配制该溶液需称取Na2CO3 10H2O晶体_________g。
10H2O晶体_________g。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:

②称量过程中Na2CO3 10H2O晶体应放于天平的________(填“左盘”或“右盘”)。
10H2O晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________
(5)转移、洗涤。 (6)定容,摇匀。
若观察定容时液面情况如图所示,所配溶液的浓度会_________(填“偏高”、“偏低”或“无影响”)。

Ⅰ(1)N Na2SO3(2)2H++2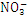 +3
+3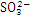
 3
3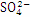 +2
+2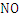 +H2O
+H2O
(3)减小
Ⅱ(1)250mL容量瓶 胶头滴管 (2)7.2 (3)① ②左
②左
(4)搅拌,加速溶解和冷却
(5)偏低
【解析】本题考查了氧化还原反应的有关知识、一定物质的量浓度溶液配制中遇到的问题。I:(1) (2)KMnO4、Na2CO3、Fe2(SO4)3中Mn、C、Fe元素都处在最高价,则具有氧化性,只有Na2SO3中Na2SO3处在较低价,则具有还原性,故还原剂为Na2SO3。在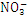 +4H++3e-
+4H++3e- NO+2H2O中发生的氧化剂被还原的反应,其中N元素由+5价降低到+2价,化合价降低,故N元素被还原。则该氧化还原反应为Na2SO3+HNO3
NO+2H2O中发生的氧化剂被还原的反应,其中N元素由+5价降低到+2价,化合价降低,故N元素被还原。则该氧化还原反应为Na2SO3+HNO3  NO↑+ Na2SO4+H2O,S元素由+4价升高到+6价,N元素由+5价降低到+2价,由电子守恒及质量守恒定律,配平的化学反应为3Na2SO3+2HNO3
NO↑+ Na2SO4+H2O,S元素由+4价升高到+6价,N元素由+5价降低到+2价,由电子守恒及质量守恒定律,配平的化学反应为3Na2SO3+2HNO3 2NO↑+ 3Na2SO4+H2O,拆开即为离子方程式2H++2
2NO↑+ 3Na2SO4+H2O,拆开即为离子方程式2H++2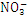 +3
+3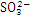
 3
3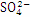 +2
+2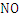
 +H2O 。
+H2O 。
(3)根据氧化还原反应中电子守恒规律,若反应后,还原产物的化合价降低,而其他物质价态保持不变,还原剂的物质的量不变,而氧化剂的物质的量会减小,氧化剂与还原剂的物质的量之比将减小。
II:(1)配制实验所需实验步骤有称量、溶解、移液、洗涤、定容以及摇匀等操作,称量药品用托盘天平,加入到烧杯中溶解并用玻璃棒搅拌,冷却后用玻璃棒引流将液体转移到250ml容量瓶中,当溶液体积距离刻度线1~2cm时改用胶头滴管定容,故答案为:胶头滴管、250ml的容量瓶。
(2) 配制该溶液需称取Na2CO3 10H2O晶体的质量为0.1mol/L×0.25L×286g/mol≈7.2g。
(3)①需称取Na2CO3 10H2O晶体的质量为7.2g,称量时需放一个5g的砝码,2.2g需调游码,应调至2g后两格。
②称量时要求左物右码。
( 4)为加快溶解和冷却速度,在溶解、冷却时需用玻璃棒不断的搅拌。
4)为加快溶解和冷却速度,在溶解、冷却时需用玻璃棒不断的搅拌。
(5) 若观察定容时仰视刻度线,会使溶液的体积增大,浓度变小。


科目:高中化学 来源: 题型:
实验是研究化学的基础,试回答以下问题:

(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察锌片上有气泡,再平行插入一块铜片(见图A),可观察到铜片________(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图B),组成一个原电池,负极为________,正极的电极反应式为________;
(2)如果烧杯中最初装入的是500 mL 2 mol·L-1的稀硫酸溶液,构成铜锌原电池(见图C,假设产生的气体没有损失),当在标准状况下收集到11.2 L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=________mol·L-1,c(ZnSO4)=________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3
ΔH=—92.4 KJ/mol,则N≡N键的键能是( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图10-1)。
在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图10-1)。
容器中发生如下反应:N2+3H2  2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
 ⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:①a=1,c=2,则b== 。在此情况下,反应起始时将向 方向(填“正”或“逆”)进行。
⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:①a=1,c=2,则b== 。在此情况下,反应起始时将向 方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是 。
⑵在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能大量共存的是
①“84”消毒液的水溶液中:Fe2+、Cl—、Ca2+、Na+
②加入KSCN显红色的溶液:K+、N 、Cl—、S2—
、Cl—、S2—
③能够与金属Cu常温下反应放出气体的溶液;Fe3+、Al3+、S 、K+
、K+
④pH=2的溶液中:N 、Na+、Cl—、Cu2+
、Na+、Cl—、Cu2+
⑤无色溶液中:K+、CH3COO—、HC 、Mn
、Mn
A.②③ B.①③ C.①⑤ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示。


(a)石墨烯结构 (b)氧化石墨烯结构
(1)基态碳原子的核外电子有 种运动状态。
(2)图(a)中,1号C与相邻C形成σ键的个数为________。
(3)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。


(4)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
(5)石墨烯可转化为富勒烯分子(C60),C60属于________晶体,某
金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位
于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料
的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法错误的是( )
A.CCl4可由CH4制得,可萃取碘水中的碘
B.石油和天然气的主要成分都是碳氢化合物
C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、Na2S、H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com